题目内容
 某学生用0.1000mol?L-1标准NaOH溶液滴定未知浓度的盐酸,其操作可分解为以下几步:
某学生用0.1000mol?L-1标准NaOH溶液滴定未知浓度的盐酸,其操作可分解为以下几步:A.移取25.00mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞溶液
B.用标准NaOH溶液润洗滴定管2~3次
C.把盛有标准NaOH溶液的碱式滴定管固定好,挤压玻璃珠,使滴定管尖嘴充满溶液
D.取标准NaOH溶液注入碱式滴定管到“0”刻度以上2~3cm
E.调节液面至“0”或“0”刻度以下,记下读数
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定到终点,并记下滴定管液面的读数
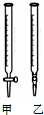
(1)右图中属于碱式滴定管的
(2)正确的操作顺序是
(3)上述B步操作的目的是
(4)判断到达滴定终点的实验现象是
(5)上述A步操作之前,若先用待测溶液润洗锥形瓶,则对滴定结果的影响是
(6)若平行实验三次,记录的数据如下表
| 滴定次数 | 待测溶液的体积(/mL) | 标准NaOH溶液的体积 | |
| 滴定前读数(/mL) | 滴定后读数(/mL) | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
考点:中和滴定
专题:实验题
分析:(1)根据滴定管的特点分析;
(2)根据中和滴定有检漏、洗涤、润洗、装液、取待测液并加指示剂、滴定等操作;
(3)用标准NaOH溶液润洗滴定管,防止产生误差;
(4)如溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(5)根据c(待测)=
判断不当操作对相关物理量的影响;
(6)根据关系式HCl~NaOH来计算出盐酸的浓度.
(2)根据中和滴定有检漏、洗涤、润洗、装液、取待测液并加指示剂、滴定等操作;
(3)用标准NaOH溶液润洗滴定管,防止产生误差;
(4)如溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(5)根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
(6)根据关系式HCl~NaOH来计算出盐酸的浓度.
解答:
解:(1)滴定管乙下端是橡皮的,为碱式滴定管;故答案为:乙;
(2)中和滴定按照检漏、洗涤、润洗、装液、取待测液并加指示剂、滴定等顺序操作,则正确的顺序为:B、D、C、E、A、F,故答案为:B、D、C、E、A、F;
(3)用标准NaOH溶液润洗滴定管2~3次,防止滴定管内壁附着的水将标准溶液稀释而带来误差,故答案为:防止滴定管内壁附着的水将标准溶液稀释而带来误差;
(4)本实验是用NaOH滴定盐酸溶液,用酚酞作指示剂,所以终点时,现象是当溶液由无色变为浅红色,且在半分钟内不褪色,
故答案为:溶液由无色变为浅红色,且半分钟内不褪色;
(5)锥形瓶用蒸馏水洗涤后,如果再用待测液润洗,会使锥形瓶内溶质的物质的量增大,会造成V(标准)偏大,根据c(待测)=
分析可知,会造成c(待测)偏大,故答案为:偏大;
(6)消耗标准NaOH溶液的体积为
mL=20.00mL;
HCl~NaOH
1 1
C(HCl)×25.00mL 0.1000mol?L-1×20.00mL;
C(HCl)=
=0.0800mol?L-1,
故答案为:0.0800mol?L-1.
(2)中和滴定按照检漏、洗涤、润洗、装液、取待测液并加指示剂、滴定等顺序操作,则正确的顺序为:B、D、C、E、A、F,故答案为:B、D、C、E、A、F;
(3)用标准NaOH溶液润洗滴定管2~3次,防止滴定管内壁附着的水将标准溶液稀释而带来误差,故答案为:防止滴定管内壁附着的水将标准溶液稀释而带来误差;
(4)本实验是用NaOH滴定盐酸溶液,用酚酞作指示剂,所以终点时,现象是当溶液由无色变为浅红色,且在半分钟内不褪色,
故答案为:溶液由无色变为浅红色,且半分钟内不褪色;
(5)锥形瓶用蒸馏水洗涤后,如果再用待测液润洗,会使锥形瓶内溶质的物质的量增大,会造成V(标准)偏大,根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
(6)消耗标准NaOH溶液的体积为
| 20.01+19.99+20.00 |
| 3 |
HCl~NaOH
1 1
C(HCl)×25.00mL 0.1000mol?L-1×20.00mL;
C(HCl)=
| 0.1000mol?L-1×20mL |
| 25mL |
故答案为:0.0800mol?L-1.
点评:本题考查酸碱中和滴定实验,题目难度不大,注意把握实验的原理、步骤、方法以及注意事项,把握实验基本操作.

练习册系列答案
相关题目
某一定量的气态烷烃在氧气中完全燃烧生成a mol二氧化碳和b mol水,则下列说法正确的是( )
| A、该烷烃的物质的量为(b-a)mol |
| B、该烷烃的物质的量为a mol |
| C、该烷烃的物质的量为(b-a)/2 mol |
| D、不能求出该烷烃的物质的量 |
A、B、C为三种短周期元素,A、B在同一周期,A、C的最低价离子分别为A2-、C-,离子半径A2-大于C-,B2+和C-具有相同的电子层结构.下列判断正确的是( )
| A、原子序数由大到小的顺序是C>A>B |
| B、原子半径由大到小的顺序是r(B)>r(A)>r(C) |
| C、离子半径由大到小的顺序是r(C-)>r(B2+)>r(A2-) |
| D、原子最外层电子数由多到少的顺序是B>A>C |
不能用来判断醋酸属于弱电解质的实验事实是( )
| A、向某浓度的醋酸钠溶液滴入几滴酚酞试液:溶液由无色变为浅红色 |
| B、向滴有甲基橙试液的醋酸溶液加入少量醋酸钠晶体:振荡后溶液由红色变为橙色 |
| C、通过对比不同浓度的导电实验:醋酸溶液的导电性较盐酸溶液的导电性弱 |
| D、取相同体积pH=1的盐酸和醋酸溶液,分别加入足量的锌,用排水法收集生成的氢气:相同条件下,醋酸生成的氢气体积大 |
使相同体积的NaCl、CaCl2、AlCl3溶液中的Cl-全部沉淀,用去同浓度的AgNO3溶液的体积分别为3V、2V、V,则NaCl、CaCl2、AlCl3溶液的物质的量浓度之比为( )
| A、6:3:2 |
| B、3:2:1 |
| C、9:3:1 |
| D、1:2:3 |
 (1)用50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1NaOH溶液在如图1所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
(1)用50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1NaOH溶液在如图1所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题: