题目内容
8.将含有2.05g某高价含氧酸的钙盐的溶液A与含1.20g碳酸盐的溶液B混合,恰好完全反应,生成1.25g白色沉淀C.将滤去沉淀C的滤液蒸发,得到白色固体D,继续加热D时,D分解只得两种气态物质的混合物,在0℃、1×105 Pa下,体积变为0.56L,并得到0.90g液态水,另一种气态物质为气态氧化物R2O.试回答:(1)白色沉淀C的物质的量为0.0125 molmol.
(2)A的摩尔质量为164 g•mol-1,B的摩尔质量为96 g•mol-1.
(3)写出D分解的化学方程式NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$N2O↑+2H2O.
分析 由A+B=C+D可推知,白色沉淀C为CaCO3,白色固体D是一种含三种元素的含氧酸盐,分解只得两种气态物质的混合物,D只能是NH4NO3,分解生成的R2O为N2O,A为Ca(NO3)2,B为(NH4)2CO3,据此进行解答.
解答 解:由A+B=C+D知,C为CaCO3,D是一种含三种元素的含氧酸盐,分解只得两种气态物质的混合物,该盐只能是NH4NO3,分解生成的R2O为N2O.A为Ca(NO3)2,B为(NH4)2CO3,
(1)1.25g碳酸钙的物质的量为:n=$\frac{m}{M}$=$\frac{1.25g}{100g/mol}$=0.0125mol,
故答案为:0.0125;
(2)A为Ca(NO3)2,摩尔质量为164 g•mol-1,B为(NH4)2CO3,摩尔质量为96 g•mol-1,
故答案为:164 g•mol-1;96 g•mol-1;
(3)D为NH4NO3,加热硝酸铵分解生成N2O和水,标况下0.56L气体的物质的量为:$\frac{0.56L}{22.4L/mol}$=0.025mol,说明生成N2O的物质的量为0.025mol;0.90g液态水的物质的量为:$\frac{0.90g}{18g/mol}$=0.05mol,则硝酸铵分解生成N2O、H2O的物质的量之比=0.025mol:0.05mol=1:2,据此可知NH4NO3分解的化学方程式为:NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$N2O↑+2H2O,
故答案为:NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$N2O↑+2H2O.
点评 本题考查无机物的推断,题目难度中等,明确常见元素及其化合物性质为解答关键,试题有利于提高学生的分析、理解能力及逻辑推理能力.

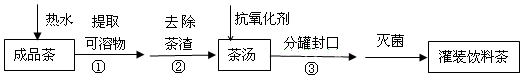
关于上述过程涉及的实验方法、实验操作和物质作用中说法不正确的是( )
| A. | ①是萃取 | B. | ②是过滤 | ||
| C. | ③是分液 | D. | 维生素C可作抗氧化剂 |
| A. | 标准状况下,VL水含有的氧原子个数约为V/22.4 NA | |
| B. | 常温常压下,1 mol 碳烯( CH2)所含的电子总数为8NA | |
| C. | 标准状况下,含NA个氩原子的氩气体积约为22.4L | |
| D. | 1mol OH-参与电解,提供的电子数目为NA个 |
| A. | Na2O2和CO2反应中,Na2O2既是氧化剂又是还原剂 | |
| B. | Na2O2、Cl2、SO2使品红溶液褪色的原理相同 | |
| C. | 等物质的量的Cl2和SO2同时通入品红溶液中,品红褪色更快 | |
| D. | 在Na2O2中阴阳离子所含的电子数目相等 |
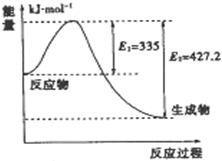 到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.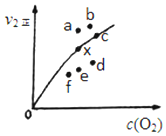 利用化学反应原理研究氮和硫的化合物有重要意义.
利用化学反应原理研究氮和硫的化合物有重要意义.
 .
.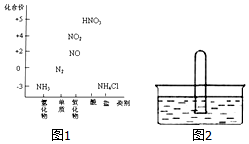 图1为氮及其化合物的类别与化合价对应的关系图.
图1为氮及其化合物的类别与化合价对应的关系图.