题目内容
镁条和盐酸反应迅速产生大量的氢气,欲使反应速率减慢,可采取的措施有:( )
①降温 ②把镁条粉碎 ③加入蒸馏水使盐酸变稀 ④升温.
①降温 ②把镁条粉碎 ③加入蒸馏水使盐酸变稀 ④升温.
| A、①② | B、②③ | C、①③ | D、②④ |
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:对于镁和盐酸的反应,可增大浓度、升高温度、增大固体的表面积,或形成原电池反应,可增大反应速率,反之反应速率降低,以此解答该题.
解答:
解:①降温,活化分子百分数减小,反应速率减小,故正确;
②把镁条粉碎,固体表面积增大,反应速率增大,故错误;
③加入蒸馏水使盐酸变稀,浓度减小,反应速率减小,故正确;
④升温,活化分子百分数增大,反应速率增大,故错误.
故选C.
②把镁条粉碎,固体表面积增大,反应速率增大,故错误;
③加入蒸馏水使盐酸变稀,浓度减小,反应速率减小,故正确;
④升温,活化分子百分数增大,反应速率增大,故错误.
故选C.
点评:本题考查化学反应速率的影响,侧重于学生的分析能力的考查,为高频考点,注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
在化学反应5NH4NO3
2HNO3+9H2O+4N2↑中,被氧化的N原子与被还原的N原子个数之比为( )
| ||
| A、3:5 | B、5:3 |
| C、5:2 | D、1:1 |
汽车尾气中含有一氧化氮和一氧化碳,消除这两种物质产生的大气污染的方法是安装催化转换器,使它们发生反应生成CO2和N2.反应方程式为:2CO+2NO
2CO2+N2,其中NO是( )
| ||
| △ |
| A、氧化剂 |
| B、还原剂 |
| C、既是氧化剂又是还原剂 |
| D、既不是氧化剂又不是还原剂 |
金属钛对体液无毒且有惰性,能与肌肉和骨骼生长在一起,因而有“生命金属”之称.下列有关
Ti和
Ti的说法中正确的是( )
48 22 |
50 22 |
A、
| ||||
B、
| ||||
C、分别由
| ||||
D、
|
关于下列图示的说法中不正确的是( )


| A、用图①所示实验可比较硫、碳、硅三种元素的非金属性强弱 |
| B、用图②所示实验装置排空气法收集H2气体 |
| C、图③表示可逆反应“CO(g)+H2O(g)?CO2(g)+H2(g)”为吸热反应 |
| D、图④两个装置中通过导线的电子数相同时,在正极上产生气体的物质的量也相同 |
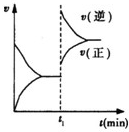 已知A(s)+2B(g)?2C(g)+D(g)△H<0 在一密闭容器中反应的υ-t图.t1时,改变了一个条件,下列叙述正确的是( )
已知A(s)+2B(g)?2C(g)+D(g)△H<0 在一密闭容器中反应的υ-t图.t1时,改变了一个条件,下列叙述正确的是( )| A、t1时,一定是升高了反应的温度 |
| B、t1时,可能是向容器中通入了一定量的C气体 |
| C、t1时,可能是向容器中加入了催化剂 |
| D、t1时改变外界条件后,该反应的平衡常数可能减小,也可能不变 |
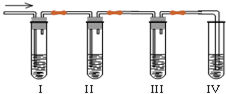 化学课外兴趣小组学生在实验室里制取的乙烯中常混有少量的二氧化硫,老师启发他们并由他们自己设计了如图实验图以确认上述混合气体中有乙烯和二氧化硫.回答下列问题:
化学课外兴趣小组学生在实验室里制取的乙烯中常混有少量的二氧化硫,老师启发他们并由他们自己设计了如图实验图以确认上述混合气体中有乙烯和二氧化硫.回答下列问题: 下列各组物质中,满足下图物质一步转化关系的选项是( )
下列各组物质中,满足下图物质一步转化关系的选项是( )