题目内容
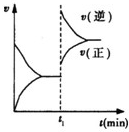 已知A(s)+2B(g)?2C(g)+D(g)△H<0 在一密闭容器中反应的υ-t图.t1时,改变了一个条件,下列叙述正确的是( )
已知A(s)+2B(g)?2C(g)+D(g)△H<0 在一密闭容器中反应的υ-t图.t1时,改变了一个条件,下列叙述正确的是( )| A、t1时,一定是升高了反应的温度 |
| B、t1时,可能是向容器中通入了一定量的C气体 |
| C、t1时,可能是向容器中加入了催化剂 |
| D、t1时改变外界条件后,该反应的平衡常数可能减小,也可能不变 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:A、反应是气体体积增大的放热反应,图象分析平衡逆向进行,正逆反应速率增大,逆反应速率增大的大分析;
B、向容器中通入了一定量的C气体,生成物浓度增大,反应物浓度此瞬间不变;
C、催化剂改变反应速率不改变化学平衡状态;
D、t1时改变外界条件可能是温度或压强,平衡常数随温度变化;
B、向容器中通入了一定量的C气体,生成物浓度增大,反应物浓度此瞬间不变;
C、催化剂改变反应速率不改变化学平衡状态;
D、t1时改变外界条件可能是温度或压强,平衡常数随温度变化;
解答:
解:A、反应是气体体积增大的放热反应,图象分析平衡逆向进行,正逆反应速率增大,逆反应速率增大的大,可能是升高温度,或增大压强可以符合图象变化,故A错误;
B、向容器中通入了一定量的C气体,生成物浓度增大,反应物浓度此瞬间不变,图象不符合,故B错误;
C、催化剂改变反应速率不改变化学平衡状态,平衡不动,图象不符合,故C错误;
D、t1时改变外界条件可能是温度或压强,平衡常数随温度变化,压强改变,平衡常数不变,t1时改变外界条件后,该反应的平衡常数可能减小,也可能不变,故D正确;
故选D.
B、向容器中通入了一定量的C气体,生成物浓度增大,反应物浓度此瞬间不变,图象不符合,故B错误;
C、催化剂改变反应速率不改变化学平衡状态,平衡不动,图象不符合,故C错误;
D、t1时改变外界条件可能是温度或压强,平衡常数随温度变化,压强改变,平衡常数不变,t1时改变外界条件后,该反应的平衡常数可能减小,也可能不变,故D正确;
故选D.
点评:本题考查了化学平衡影响因素的分析判断,主要是图象分析,平衡移动原理的分析应用,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
镁条和盐酸反应迅速产生大量的氢气,欲使反应速率减慢,可采取的措施有:( )
①降温 ②把镁条粉碎 ③加入蒸馏水使盐酸变稀 ④升温.
①降温 ②把镁条粉碎 ③加入蒸馏水使盐酸变稀 ④升温.
| A、①② | B、②③ | C、①③ | D、②④ |
某温度下,在一固定体积的密闭容器中,进行如下化学反应:H2(g)+I2(g)?2HI(g).下列情
况能说明该反应一定达到平衡的是( )
况能说明该反应一定达到平衡的是( )
| A、混合气体的颜色不再改变的状态 |
| B、混合气体的压强不再改变的状态 |
| C、单位时间内拆开1mol H-H键,同时拆开1mol H-I键 |
| D、混合气体的密度不再改变的状态 |
将0.2摩/升的氢氧化钠和0.1摩/升的醋酸等体积混合,有关溶液中离子浓度的判断正确的是( )
| A、c(Na+)>c (H+)>c (CH3COO-)>c (OH-) |
| B、c (Na+)>c (CH3COO-)>c (OH-)>c (H+) |
| C、c (Na+)+c (H+)=c (OH-)+c (CH3COO-) |
| D、c (Na+)=c (OH-)>c (CH3COO-)=c (H+) |
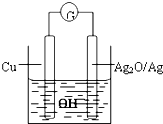 普通水泥在固化过程中自由水分子减少,并且溶液呈碱性.根据这一物理化学特点,科学家发明了电动势法测水泥初凝时间.此法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O+2Ag,下列有关说法正确的是( )
普通水泥在固化过程中自由水分子减少,并且溶液呈碱性.根据这一物理化学特点,科学家发明了电动势法测水泥初凝时间.此法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O+2Ag,下列有关说法正确的是( )| A、工作时,负极周围海水的pH增大 |
| B、测量原理示意图中,Ag2O为负极 |
| C、负极的电极反应式为:2Cu+2OH--2e-=Cu2O+H2O |
| D、电池工作时,OH-向正极移动 |
下列变化中,发生还原反应的是( )
| A、KCl→AgCl |
| B、CuSO4→Cu |
| C、CaCO3 →CO2 |
| D、H2→H2O |
某些物质发生化学反应时,化学能可以转化为电能,这类化学反应是( )
| A、非氧化还原反应 |
| B、氧化还原反应 |
| C、放热反应 |
| D、吸热反应 |