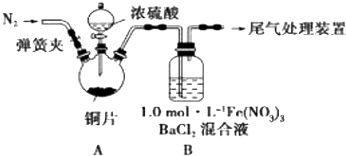
题目内容
17.下列各组数据中,其比值为2:1的是( )| A. | 氨水与(NH4)2SO4溶液混合后pH=7的溶液中,[NH4+]:[SO42-] | |
| B. | 相同温度下,0.2 mol•L-1乙酸溶液与0.1 mol•L-1乙酸溶液中,[H+]之比 | |
| C. | Na2CO3溶液中,[Na+]:[CO32-] | |
| D. | pH=12的Ba(OH)2溶液与pH=12的KOH溶液中,c[Ba(OH)2]:c(KOH) |
分析 A.(NH4)2SO4与NH3•H2O的混合溶液中存在电荷守恒:c (NH4+)+c(H+)=2c(SO42-)+c(OH-),25℃时,pH=7是显中性的溶液,据此进行判断;
B.乙酸溶液中,乙酸浓度不同,则乙酸的电离程度不相同;
C.碳酸钠溶液中碳酸根离子水解,浓度减小;
D.氢氧化钡和氢氧化钾都是强电解质,溶液的pH相同,则氢氧根离子浓度相同.
解答 解:A.NH4)2SO4与NH3•H2O的混合溶液中存在电荷守恒:c (NH4+)+c(H+)=2c(SO42-)+c(OH-),25℃时,pH=7是显中性的溶液,故c(H+)=c(OH-),所以c(NH4+)=2c(SO42-),c(NH4+):c(SO42-)=2:1,故A正确;
B.相同温度下,乙酸浓度越大,电离程度越小,则0.2 mol•L-1乙酸与0.1mol•L-1乙酸中相比,前者乙酸的电离程度小于后者,则前后两溶液中氢离子浓度之比小于2:1,故B错误;
C.碳酸钠溶液中碳酸根离子水解,浓度减小,所以Na2CO3溶液中,[Na+]:[CO32-]大于2:1,故C错误;
D.pH=12的Ba(OH)2溶液与pH=12的KOH溶液中,氢氧化钡和氢氧化钾都是强电解质,溶液的pH相同,则氢氧根离子浓度相同,在水溶液里完全电离,pH=12的KOH溶液与pH=12的Ba(OH)2溶液中氢氧根离子浓度相等,根据其化学式知,二者之间的物质的量浓度之比2:1,故D正确;
故选AD.
点评 本题考查了溶液中离子浓度大小比较、弱电解质在溶液中的电离平衡等知识,题目难度中等,注意掌握弱电解质的电离平衡及其影响,明确溶液酸碱性与溶液pH的关系,试题侧重考查学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
相关题目
12.已知25℃时部分弱电解质的电离平衡常数数据如表所示:
回答下列问题:
(1)物质的量浓度均为0.1mol•L-1的四种溶液;
a.CH3COONa b.Na2CO3c.NaClO d.NaHCO3
pH由小到大排列的顺序是a<d<c<b(用编号填写).
(2)常温下,0.1mol•L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BD.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$ E.$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
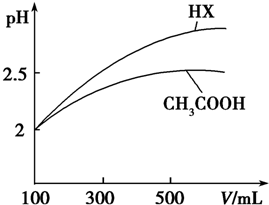
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数大于(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是稀释相同倍数,一元酸HX的pH变化比CH3COOH的大,故HX酸性较强,电离平衡常数较大.
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7mol•L-1(填精确值).
(5)标准状况下,将1.12L CO2通入100mL 1mol•L-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:
①c (OH-)=2c(H2CO3)+c(HCO3-)+c(H+);②c(H+)+c(Na+)=c(HCO3-)+c(CO32-)+c(OH-).
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |

(1)物质的量浓度均为0.1mol•L-1的四种溶液;
a.CH3COONa b.Na2CO3c.NaClO d.NaHCO3
pH由小到大排列的顺序是a<d<c<b(用编号填写).
(2)常温下,0.1mol•L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BD.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$ E.$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数大于(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是稀释相同倍数,一元酸HX的pH变化比CH3COOH的大,故HX酸性较强,电离平衡常数较大.
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7mol•L-1(填精确值).
(5)标准状况下,将1.12L CO2通入100mL 1mol•L-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:
①c (OH-)=2c(H2CO3)+c(HCO3-)+c(H+);②c(H+)+c(Na+)=c(HCO3-)+c(CO32-)+c(OH-).
9.下列物质按照纯净物、混合物、电解质和非电解质顺序排列的是( )
| A. | 盐酸、水煤气、醋酸、干冰 | B. | 液氯、氯水、硫酸钠、乙醇 | ||
| C. | 空气、天然气、苛性钾、硫酸钡 | D. | 胆矾、漂白粉、氯化钾、氯气 |
6.在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,1molCuSO4能氧化P的物质的量为( )
| A. | $\frac{11}{15}$ mol | B. | $\frac{2}{5}$mol | C. | $\frac{3}{5}$mol | D. | $\frac{1}{5}$ mol |
 .
.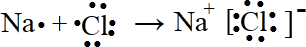 .
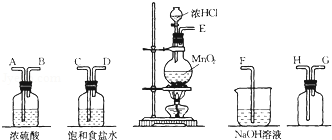
.
 水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.
水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.