题目内容
5.在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图: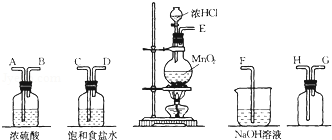
(1)连接上述仪器的正确顺序是:E接C,D接A,B接H,G接F.
(2)气体发生装置中进行的反应化学方程式是4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;当0.5mol MnO2参与反应时,被氧化的HCl的质量为36.5g,生成的Cl2在标准状况下的体积约为11.2L.
(3)在装置中:①饱和食盐水的作用是除去Cl2中的HCl,②浓硫酸的作用是干燥氯气.
(4)化学实验中检验是否有Cl2产生常用湿润的淀粉-KI试纸.如果有Cl2产生,可观察到的现象是试纸变蓝,写出反应方程式Cl2+2KI=I2+2KCl.
(5)写出尾气吸收装置中进行的反应的化学方程式Cl2+2NaOH=NaCl+NaClO+H2O.
分析 (1)在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气,需要发生装置生成氯气,用饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,导气管长进短处收集氯气,最后用氢氧化钠溶液吸收多余的氯气,据此连接仪器;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,反应方程式:4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;依据方程式反应中消耗1mol二氧化锰,有2mol氯化氢被氧化,生成1mol氯气,据此计算解答;
(3)依据浓盐酸易挥发,制备的氯气中含有氯化氢和水蒸气杂质解答;
(4)氯气具有强的氧化性,能够氧化碘化钾生成单质碘;
(5)氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水.
解答 解:(1)在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气,需要发生装置生成氯气,用饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,导气管长进短处收集氯气,最后用氢氧化钠溶液吸收多余的氯气,装置连接顺序是 E C D A B H G F,
故答案为:C D A B H G;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,化学方程式:4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;反应中消耗1mol二氧化锰,有2mol氯化氢被氧化,生成1mol氯气,所以当0.5mol MnO2参与反应时,被氧化的HCl的质量为1mol,质量为36.5g;生成氯气的物质的量为0.5mol,标况下气体的体积为0.5mol×22.4L/mol=11.2L;
故答案为:4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O; 36.5g; 11.2L;
(3)盐酸易挥发,制取的氯气中含有氯化氢和水蒸气,氯气在饱和食盐水中溶解度不大,氯化氢易溶于水,选择饱和食盐水除去氯气中的氯化氢;
浓硫酸具有吸水性,选择浓硫酸做干燥剂,干燥氯气;
故答案为:①除去Cl2中的HCl; ②干燥氯气;
(4)氯气具有强的氧化性,能够氧化碘化钾生成单质碘,化学方程式:;Cl2+2 KI=I2+2 KCl,碘遇到淀粉变蓝;
故答案为:试纸变蓝;Cl2+2 KI=I2+2 KCl;
(5)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,化学方程式:Cl2+2 NaOH=NaCl+NaClO+H2O;
故答案为:Cl2+2 NaOH=NaCl+NaClO+H2O.
点评 本题考查了氯气的实验室制备和性质检验,明确制备原理及氯气的化学性质是解题关键,题目难度不大.

| A. | “臭氧空洞”“温室效应”“光化学烟雾”“硝酸型酸雨”的形成过程都与氮氧化合物有关 | |
| B. | 石油裂解、煤的气化、海水制镁、石油中提取石蜡等过程中都包含化学变化 | |
| C. | 低碳经济就是以低耗能、低污染、低排放为基础的经济发展模式 | |
| D. | 可利用丁达尔效应鉴别氢氧化铁胶体和氯化铁溶液 |
| A. | 盐酸、漂白粉都是混合物 | B. | 127I和131I互为同素异形体 | ||
| C. | 硫酸铜、蔗糖都是电解质 | D. | 分馏、干馏都是物理变化 |
| A. | 铝制餐具不宜用来蒸煮或长时间存放酸性、碱性或咸的食物 | |
| B. | 发酵粉中含有的碳酸氢钠,能使焙制出的糕点疏松多孔 | |
| C. | Na2O2既可作呼吸面具中O2的来源,又可漂白织物、麦杆、羽毛等 | |
| D. | 明矾能水解生成Al(OH)3胶体,常用作生活用水的消毒剂 |
①分液、萃取、蒸馏 ②萃取、蒸馏、分液 ③分液、蒸馏、萃取 ④蒸馏、萃取、分液.
| A. | 标准状况下,11.2LCCl4中含有的分子数目为0.5NA | |
| B. | 常温下,1L0.1mol/LCH3COOH溶液中含有的H+数目为0.1NA | |
| C. | 25℃,PH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| D. | 1L 1mol/L的NH4Cl溶液中,所含NH4+的数目小于NA |
| A. | 氨水与(NH4)2SO4溶液混合后pH=7的溶液中,[NH4+]:[SO42-] | |
| B. | 相同温度下,0.2 mol•L-1乙酸溶液与0.1 mol•L-1乙酸溶液中,[H+]之比 | |
| C. | Na2CO3溶液中,[Na+]:[CO32-] | |
| D. | pH=12的Ba(OH)2溶液与pH=12的KOH溶液中,c[Ba(OH)2]:c(KOH) |
(1)将6.62g铁矿石样品投入足量的盐酸中完全溶解后过滤,滤渣中不含铁元素.在滤液中加过量的NaOH溶液,充分反应,过滤、洗涤、灼烧得4.80g Fe2O3,求该铁矿石含铁的质量分数.
(2)现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00吨生铁(含铁96%),至少需要这种铁矿石多少吨?(保留两位小数)
(3)取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况).计算此钢样粉末中铁和碳的物质的量之比.
(4)再取三份不同质量的上述钢样粉末,分别加到100mL相同浓度的H2SO4溶液中,充分反应后,测得的实验数据如下表所示:
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 加入钢样粉末的质量/g | 2.812 | 5.624 | 8.436 |
| 生成气体的体积/L(标准状况) | 1.120 | 2.240 | 2.800 |
(5)若在实验Ⅱ中继续加入mg钢样粉末,计算反应结束后剩余的固体质量为多少?(用含m的代数式表示)
| A. | 增加H2O(g) 的量 | |
| B. | 增加C(s)的量 | |
| C. | 将容器的体积缩小一半 | |
| D. | 保持压强不变,充入N2,使容器的体积变大 |