题目内容
7.有A、B、C、D四种短周期元素,A元素形成的-2价阴离子比氦原子的核外电子数多8个,B元素的焰色反应呈黄色,C为原子核内有12个中子的二价金属,当2.4克C与足量热水反应时,在标准状况下放出气体2.24L,D的M层上7个电子.(1)写出ABCD元素符号:
AO;
BNa;
CMg;
DCl.
(2)B的离子结构示意图
 .
.(3)比较D的气态氢化物与H2S和HF的稳定性HF>HCl>H2S.
(4)用电子式表示B与D形成的化合物的过程:
 .
.(5)C与D两元素最高价氧化物的水化物反应的离子方程式:Mg(OH)2+2H+=Mg2++2H2O.
分析 现有A、B、C、D四种元素,A元素形成的-2价阴离子比氦原子的核外电子数多8个,则A为氧元素;B元素的焰色反应呈黄色,则B为钠元素;C为原子核内有12个中子的金属元素,当2.4g C与足量热水反应时,在标准状况下放出气体2.24L,C形成正二价阳离子,令C的摩尔质量为xg/mol,则$\frac{2.4}{x}$×2=$\frac{2.24}{2.24}$×2,解得x=24,所以C是质子数为24-12=12,故C为镁元素;D元素原子的M层上有7个电子,则D为氯元素,据此解答.
解答 解:现有A、B、C、D四种元素,A元素形成的-2价阴离子比氦原子的核外电子数多8个,则A为氧元素;B元素的焰色反应呈黄色,则B为钠元素;C为原子核内有12个中子的金属元素,当2.4g C与足量热水反应时,在标准状况下放出气体2.24L,C形成正二价阳离子,令C的摩尔质量为xg/mol,则$\frac{2.4}{x}$×2=$\frac{2.24}{2.24}$×2,解得x=24,所以C是质子数为24-12=12,故C为镁元素;D元素原子的M层上有7个电子,则D为氯元素,
(1)由上述分析可知,A为O元素,B为Na元素,C为Mg元素,D为Cl元素.
故答案为:O; Na; Mg; Cl;
(2)B为钠元素,核内质子数为11,核外电子数为10,有2个电子层,最外层有8个电子,钠离子结构示意图为 ,故答案为:
,故答案为: ;
;
(3)非金属性F>Cl>S,所以氢化物稳定性HF>HCl>H2S,故答案为:HF>HCl>H2S;
(4)氯化钠是离子化合物,由钠离子与氯离子构成,用电子式表示氯化钠形成的过程为:
故答案为: ;
;
(5)C与D两元素最高价氧化物的水化物分别为Mg(OH)2、HClO4,反应离子方程式为Mg(OH)2+2H+=Mg2++2H2O.
故答案为:Mg(OH)2+2H+=Mg2++2H2O.
点评 本题考查结构性质与位置关系、电子式与结构示意图、离子方程式等常用化学用语、元素周期律等,难度不大,推断元素是解题的关键,注意基础知识的理解掌握.

| A. | “臭氧空洞”“温室效应”“光化学烟雾”“硝酸型酸雨”的形成过程都与氮氧化合物有关 | |
| B. | 石油裂解、煤的气化、海水制镁、石油中提取石蜡等过程中都包含化学变化 | |
| C. | 低碳经济就是以低耗能、低污染、低排放为基础的经济发展模式 | |
| D. | 可利用丁达尔效应鉴别氢氧化铁胶体和氯化铁溶液 |
| A. | 盐酸、漂白粉都是混合物 | B. | 127I和131I互为同素异形体 | ||
| C. | 硫酸铜、蔗糖都是电解质 | D. | 分馏、干馏都是物理变化 |
| A. | 氨水与(NH4)2SO4溶液混合后pH=7的溶液中,[NH4+]:[SO42-] | |
| B. | 相同温度下,0.2 mol•L-1乙酸溶液与0.1 mol•L-1乙酸溶液中,[H+]之比 | |
| C. | Na2CO3溶液中,[Na+]:[CO32-] | |
| D. | pH=12的Ba(OH)2溶液与pH=12的KOH溶液中,c[Ba(OH)2]:c(KOH) |
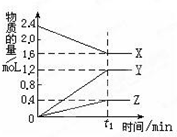 某温度下,在2L密闭容器中,3种气态物质X、Y、Z的物质的量随时间 变化曲线如图.
某温度下,在2L密闭容器中,3种气态物质X、Y、Z的物质的量随时间 变化曲线如图.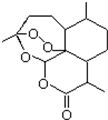 2015年诺贝尔奖获得者屠呦呦提取的抗疟新药青蒿素的结构简式,用键线式表示如图.
2015年诺贝尔奖获得者屠呦呦提取的抗疟新药青蒿素的结构简式,用键线式表示如图. ,需要在有机合成中引入羟基,引入羟基的反应类型有①②⑤.(选填编号)
,需要在有机合成中引入羟基,引入羟基的反应类型有①②⑤.(选填编号)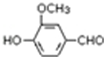 )可用于合成青蒿素,合成天然香草醛的反应如下:
)可用于合成青蒿素,合成天然香草醛的反应如下:
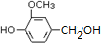 .
.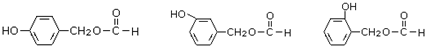 (其中之一).
(其中之一).
 ;
;