题目内容
下列热化学方程式表达正确的是(△H的绝对值均正确)( )
| A、C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g)△H=-1367.0 kJ/mol(燃烧热) |
| B、NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1)△H=+57.3kJ/mol(中和热) |
| C、S(s)+O2(g)=SO2(g)△H=-269.8kJ/mol (反应热) |
| D、2NO2=O2+2NO△H=+116.2kJ/mol (反应热) |
考点:热化学方程式
专题:
分析:A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;
B、中和热是强酸强碱的稀溶液完全反应生成1mol水放出的热量;
C、热化学方程式是标注物质聚集状态,反应放出的热量;
D、热化学方程式是标注物质聚集状态,反应放出的热量.
B、中和热是强酸强碱的稀溶液完全反应生成1mol水放出的热量;
C、热化学方程式是标注物质聚集状态,反应放出的热量;
D、热化学方程式是标注物质聚集状态,反应放出的热量.
解答:
解:A、C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g)△H=-1367.0 kJ/mol(燃烧热)反应中生成的氧化物水是气体,不是稳定氧化物,故A错误;
B、NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ/mol(中和热),故B错误;
C、S(s)+O2(g)=SO2(g)△H=-269.8kJ/mol(反应热),符合热化学方程式的书写,故C正确;
D、2NO2=O2+2NO△H=+116.2kJ/mol(反应热),未标注物质聚集状态,故D错误;
故选C.
B、NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ/mol(中和热),故B错误;
C、S(s)+O2(g)=SO2(g)△H=-269.8kJ/mol(反应热),符合热化学方程式的书写,故C正确;
D、2NO2=O2+2NO△H=+116.2kJ/mol(反应热),未标注物质聚集状态,故D错误;
故选C.
点评:本题考查了燃烧热、中和热、热化学方程式的书写方法和判断,关键是概念的理解,题目较简单.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
洋蓟属高档蔬菜,从洋蓟提取的物质A具有良好的保健功能和药用价值,A在酸性条件下水解可生成B和C,反应可表示为下列说法不正确的是( )
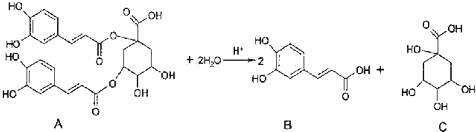

| A、A在一定条件下能发生取代反应、加成反应和消去反应 |
| B、1mol A和足量NaOH溶液反应,最多消耗11molNaOH |
| C、B能和浓溴水发生反应,1mol B最多消耗4 molBr2 |
| D、C分子中含有手性碳原子 |
下列有关平衡常数叙述中,正确的是( )
| A、不同浓度的同一弱电解质,其电离常数(K)不同 |
| B、温度越高,化学平衡常数一定越大 |
| C、平衡常数发生变化,化学平衡必定发生移动,达到新的平衡 |
| D、化学平衡发生移动,平衡常数必发生变化 |
已知有机反应RH+Cl2(气)
RCl(液)+HCl(气),若在农药和有机合成工业中将HCl转化副产品盐酸,则从上述反应产物中分离得到盐酸的最佳方法是( )
| 光 |
| A、蒸馏法 | B、水洗分液法 |
| C、升华法 | D、有机溶剂萃取法 |
化学是一门以实验为基础的学科,化学实验是化学学习的重要内容.根据你掌握的知识判断,下列实验操作的描述中,正确的是 ( )
| A、从试剂瓶中取出的任何药品,若有剩余不能再放回原试剂瓶 |
| B、用稀盐酸洗涤盛放过石灰水的试剂瓶 |
| C、配制H2SO4溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 |
| D、各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘纸上称量 |
| E、Na2CO3溶液不能保存在带有玻璃塞的试剂瓶中 |
| F、将用水润湿的pH试纸浸入稀盐酸中,测定溶液的pH. |
对下列事实的解释错误的是( )
| A、用氢氟酸雕刻玻璃,是由于氢氟酸能与二氧化硅反应 |
| B、用75%的乙醇溶液进行消毒,是由于乙醇能使蛋白质变性 |
| C、用铁制容器储运浓硫酸或浓硝酸,是由于铁与浓硫酸或浓硝酸不反应 |
| D、向Na2O2与水完全反应后的溶液中加MnO2产生O2,可能该溶液中含H2O2 |
 ,则乙醇发生消去反应时断裂的键是
,则乙醇发生消去反应时断裂的键是