题目内容
下列平衡体系中,升温或减压都能使平衡向正反应方向移动的是(△H<0表示放热)( )
| A、N2(g)+3H2(g)?2NH3(g)△H<0 |
| B、N2(g)+O2(g)?2NO(g)△H<0 |
| C、C(s)+2H2O(g)?CO2(g)+2H2(g)△H>0 |
| D、2SO2(g)+O2(g)?2SO3(g)△H<0 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:减压平衡正向移动,说明正反应气体体积增大,升温平衡正向移动,说明正反应吸热,据此分析.
解答:
解:减压平衡正向移动,说明正反应气体体积增大,升温平衡正向移动,说明正反应吸热.
A.正反应气体体积减小,故A错误;
B.正反应是放热反应,故B错误;
C.正反应是吸热反应且气体体积增大,故C正确;
D.正反应是放热反应,故D错误.
故选C.
A.正反应气体体积减小,故A错误;
B.正反应是放热反应,故B错误;
C.正反应是吸热反应且气体体积增大,故C正确;
D.正反应是放热反应,故D错误.
故选C.
点评:本题考查了化学平衡移动的影响因素,据勒夏特列原理分析即可,难度不大,侧重对基础知识的巩固,注意对基础知识的理解掌握.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
下列有关实验原理或实验操作结论正确的是( )
| A、配制酸性KMnO4溶液时,用盐酸酸化 |
| B、用水湿润pH试纸测量某溶液的pH值 |
C、实验室用右图所示装置除去Cl2中的少量HCl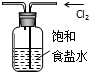 |
| D、用盐酸标准溶液滴定待测的氢氧化钠溶液时,水洗后的酸式滴定管未经标准液润洗,则测定结果偏低 |
一定温度下,下列溶液的离子浓度关系式正确的是( )
| A、pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③ | ||
| B、pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5 mol?L-1 | ||
| C、pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | ||
D、pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O
|
下列有关平衡常数叙述中,正确的是( )
| A、不同浓度的同一弱电解质,其电离常数(K)不同 |
| B、温度越高,化学平衡常数一定越大 |
| C、平衡常数发生变化,化学平衡必定发生移动,达到新的平衡 |
| D、化学平衡发生移动,平衡常数必发生变化 |
化学是一门以实验为基础的学科,化学实验是化学学习的重要内容.根据你掌握的知识判断,下列实验操作的描述中,正确的是 ( )
| A、从试剂瓶中取出的任何药品,若有剩余不能再放回原试剂瓶 |
| B、用稀盐酸洗涤盛放过石灰水的试剂瓶 |
| C、配制H2SO4溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 |
| D、各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘纸上称量 |
| E、Na2CO3溶液不能保存在带有玻璃塞的试剂瓶中 |
| F、将用水润湿的pH试纸浸入稀盐酸中,测定溶液的pH. |
下列叙述正确的是( )
| A、固体氯化钠不导电,所以氯化钠不是电解质 |
| B、氯化氢水溶液能导电,所以氯化氢是电解质 |
| C、CO2溶于水能导电,所以 CO2是电解质 |
| D、铜丝能导电,所以铜是电解质 |