题目内容
6.某烃的结构简式为 分子中处于四面体结构中心的碳原子数为a,一定处在同一平面内的碳原子数为b,一定处在同一直线上的碳原子数为c,则a、b、c依次为( )
分子中处于四面体结构中心的碳原子数为a,一定处在同一平面内的碳原子数为b,一定处在同一直线上的碳原子数为c,则a、b、c依次为( )| A. | 4、5、3 | B. | 4、6、3 | C. | 2、4、5 | D. | 4、4、6 |
分析 根据乙烯的共面结构以及乙炔的共线结构来分析有机物的结构.
解答 解:有机物 中,含有乙烯的共面基本结构部分,含有乙炔的共线基本结构,线可以在面上,所以一定在同一平面内的碳原子数为6个,即b=6,在同一直线上的碳原子数即为符合乙炔的结构的碳原子,最多为3个,即c=3,甲基碳和乙基碳原子是含有四面体结构的碳原子(即饱和碳原子)为4个,即a=4,
中,含有乙烯的共面基本结构部分,含有乙炔的共线基本结构,线可以在面上,所以一定在同一平面内的碳原子数为6个,即b=6,在同一直线上的碳原子数即为符合乙炔的结构的碳原子,最多为3个,即c=3,甲基碳和乙基碳原子是含有四面体结构的碳原子(即饱和碳原子)为4个,即a=4,
故选B.
点评 本题考查学生有机物的共线和共面知识,可以根据基本物质的结构来分析,难度中等.

练习册系列答案
相关题目
17.下列离子方程式,一定不正确的是.( )
| A. | 实验室用石灰石和盐酸反应制取CO2:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | H2O2溶液中滴加酸性KMnO4溶液:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O | |
| C. | 铁屑溶于过量稀硝酸:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| D. | NaHCO3溶液与足量Ba(OH)2溶液反应:HCO3-+Ba2++OH-═BaCO3↓+H2O |
14.下列各组分子中,都属于含有极性键的非极性分子的一组是( )
| A. | CO2、H2O | B. | C2H4、CH4 | C. | Cl2、C2H2 | D. | N2H4、H2O2 |
1.有一块铝铁合金溶于足量盐酸中,再用过量的NaOH溶液处理,将产生的沉淀过滤、洗涤、干燥、灼烧后,剩余固体粉末的质量与原合金质量恰好相等,则合金中铝的含量为( )
| A. | 30% | B. | 70% | C. | 47.6% | D. | 52.4% |
11.下列物质中含有共价键的离子化合物是( )
| A. | CaF2 | B. | KOH | C. | CO2 | D. | CH4 |
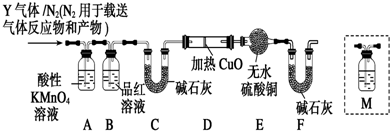
18.如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已省略).
(1)装置A是氯气的发生装置,期中盛放浓盐酸的仪器名称是分液漏斗,请写出反应的化学方程式:Ca(ClO)2 +4HCl(浓)=2Cl2↑+CaCl2+2H2O.
(2)装置B中的饱和食盐水的作用是除去Cl2中的HCl.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III处依次放入的物质的组合应该是d.(填字母编号)
(4)装置F的作用是吸收多余的氯气,防止污染大气,其烧杯中的溶液不能选用下列中的b.
a.饱和NaOH溶液 b.饱和Ca(OH)2溶液
c.饱和Na2SO3溶液 d.饱和Na2CO3溶液.

(1)装置A是氯气的发生装置,期中盛放浓盐酸的仪器名称是分液漏斗,请写出反应的化学方程式:Ca(ClO)2 +4HCl(浓)=2Cl2↑+CaCl2+2H2O.
(2)装置B中的饱和食盐水的作用是除去Cl2中的HCl.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III处依次放入的物质的组合应该是d.(填字母编号)
| 编号 | I | II | III |
| a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
| c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
a.饱和NaOH溶液 b.饱和Ca(OH)2溶液
c.饱和Na2SO3溶液 d.饱和Na2CO3溶液.
15. 随着原子序数的递增,五种短周期元素原子半径的相对大小和最高正价或最低负价如图所示.下列说法不正确的是( )
随着原子序数的递增,五种短周期元素原子半径的相对大小和最高正价或最低负价如图所示.下列说法不正确的是( )
 随着原子序数的递增,五种短周期元素原子半径的相对大小和最高正价或最低负价如图所示.下列说法不正确的是( )
随着原子序数的递增,五种短周期元素原子半径的相对大小和最高正价或最低负价如图所示.下列说法不正确的是( )| A. | X2W能与WY2反应生成W | |
| B. | 气态氢化物的稳定性:W>Q | |
| C. | Y分别与其它四种元素均可形成至少两种以上化合物 | |
| D. | Y、Z、Q三种元素组成化合物的水溶液可能呈中性,也可能呈碱性 |