题目内容
13.下列变化克服的是分子间作用力的是( )| A. | 氯化钠晶体熔化 | B. | 电解水 | ||
| C. | 碘升华 | D. | 硫化氢受热分解为氢气和硫 |
分析 先判断断键方式,再判断克服的作用力,只需克服分子间作用力,则晶体为分子晶体,且未发生化学键断裂.
A.氯化钠属于离子晶体,氯化钠晶体熔化破坏化学键;
B.水属于分子晶体,电解水发生化学变化;
C.碘单质属于分子晶体,碘升华属于物质的状态变化;
D.硫化氢属于分子晶体,硫化氢受热分解为氢气和硫发生化学反应.
解答 解:A.氯化钠晶体是离子晶体,微粒间的作用力是离子键,氯化钠晶体熔化离子键被破坏,故A错误;
B.电解水生成氢气、氧气,发生化学变化,破坏是氢、氧间的共价键,故B错误;
C.固体碘升华,只破坏分子间作用力,故C正确;
D.硫化氢属于分子晶体,硫化氢受热分解为氢气和硫,破坏是氢、硫间的共价键,故D错误;
故选C.
点评 本题考查物质的成键方式,此类题的解题方法是:先判断断键方式,再判断克服的作用力,题目难度不大.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案
相关题目
4.电镀工业会产生大量的电镀污水,处理电镀污水时会产生大量的电镀污泥.电镀污泥含.有多种金属氢氧化物和杂质.下面是处理某种电镀污泥回收铜、镍元素的一种工业流程.
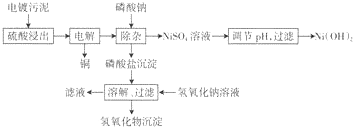
电镀污泥用硫酸浸出后得到的浸出液中各金属离子浓度见下表.
(1)硫酸浸出过程中,为提高浸出速率,可以采取的措施有加热、增大硫酸浓度、搅拌(写出两条).
(2)在电解回收铜的过程中,为提高下一步的除杂效果,需控制电解电压稍大一些使Fe2+氧化,则磷酸盐沉淀中含有的物质为FePO4、CrPO4、AlPO4.
(3)假设电解前后Ni2+浓度基本不变,若使Ni2+在除杂过程不损失,则溶液中P043-浓度不能超过$\sqrt{\frac{5×1{0}^{-31}}{(\frac{7}{59})^{3}}}$mol.L-l.(列出计算表达式,Ksp[Ni3(P04)2]=5xl0-31)
(4)滤液中的Na3PO4可回收循环使用;研究发现当NaOH溶液浓度过大时,部分铝元素和铬元素会在滤液中出现,滤液中出现铝元素的原因为Al(OH)3+OH-=AlO2-+2H2O(用离子方程式解释).
(5)Ni(OH)2是镍氢蓄电池的正极材料,在碱性电解质中,电池充电时Ni(OH)2变为NiOOH,则电池放电时正极的电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-.
(6)电镀污水中的Cr元素也可以用铁氧体法处理,原理为在废水中加入过量的FeS04,在酸性条件下Cr2072-被还原为Cr3+,同时生成Fe3+;再加入过量的强碱生成铁铬氧体(CrxFe3-xO4)沉淀.写出加入过量强碱生成铁铬氧体( CrxFe3-xO4)沉淀的离子方程式xCr3++Fe2++(2-x)Fe3++8OH-=CrxFe3-xO4↓+4H2O.

电镀污泥用硫酸浸出后得到的浸出液中各金属离子浓度见下表.
| 金属离子 | Cu3+ | Ni3+ | Fe3+ | Al3+ | Cr3+ |
| 浓度(mg/L) | 7000 | 7000 | 2500 | 4200 | 3500 |
(2)在电解回收铜的过程中,为提高下一步的除杂效果,需控制电解电压稍大一些使Fe2+氧化,则磷酸盐沉淀中含有的物质为FePO4、CrPO4、AlPO4.
(3)假设电解前后Ni2+浓度基本不变,若使Ni2+在除杂过程不损失,则溶液中P043-浓度不能超过$\sqrt{\frac{5×1{0}^{-31}}{(\frac{7}{59})^{3}}}$mol.L-l.(列出计算表达式,Ksp[Ni3(P04)2]=5xl0-31)
(4)滤液中的Na3PO4可回收循环使用;研究发现当NaOH溶液浓度过大时,部分铝元素和铬元素会在滤液中出现,滤液中出现铝元素的原因为Al(OH)3+OH-=AlO2-+2H2O(用离子方程式解释).
(5)Ni(OH)2是镍氢蓄电池的正极材料,在碱性电解质中,电池充电时Ni(OH)2变为NiOOH,则电池放电时正极的电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-.
(6)电镀污水中的Cr元素也可以用铁氧体法处理,原理为在废水中加入过量的FeS04,在酸性条件下Cr2072-被还原为Cr3+,同时生成Fe3+;再加入过量的强碱生成铁铬氧体(CrxFe3-xO4)沉淀.写出加入过量强碱生成铁铬氧体( CrxFe3-xO4)沉淀的离子方程式xCr3++Fe2++(2-x)Fe3++8OH-=CrxFe3-xO4↓+4H2O.
1.有一块铝铁合金溶于足量盐酸中,再用过量的NaOH溶液处理,将产生的沉淀过滤、洗涤、干燥、灼烧后,剩余固体粉末的质量与原合金质量恰好相等,则合金中铝的含量为( )
| A. | 30% | B. | 70% | C. | 47.6% | D. | 52.4% |
18.如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已省略).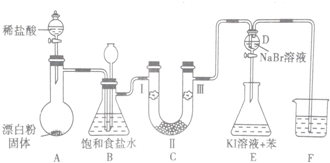
(1)装置A是氯气的发生装置,期中盛放浓盐酸的仪器名称是分液漏斗,请写出反应的化学方程式:Ca(ClO)2 +4HCl(浓)=2Cl2↑+CaCl2+2H2O.
(2)装置B中的饱和食盐水的作用是除去Cl2中的HCl.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III处依次放入的物质的组合应该是d.(填字母编号)
(4)装置F的作用是吸收多余的氯气,防止污染大气,其烧杯中的溶液不能选用下列中的b.
a.饱和NaOH溶液 b.饱和Ca(OH)2溶液
c.饱和Na2SO3溶液 d.饱和Na2CO3溶液.

(1)装置A是氯气的发生装置,期中盛放浓盐酸的仪器名称是分液漏斗,请写出反应的化学方程式:Ca(ClO)2 +4HCl(浓)=2Cl2↑+CaCl2+2H2O.
(2)装置B中的饱和食盐水的作用是除去Cl2中的HCl.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III处依次放入的物质的组合应该是d.(填字母编号)
| 编号 | I | II | III |
| a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
| c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
a.饱和NaOH溶液 b.饱和Ca(OH)2溶液
c.饱和Na2SO3溶液 d.饱和Na2CO3溶液.
2.已知X、Y、Z、W(含同一元素)有如转化关系,若X是一种单质,W为一种含氧酸,则X不可能是( )
X$\stackrel{O_{2}}{→}$Y$\stackrel{O_{2}}{→}$Z$\stackrel{H_{2}O}{→}$W.
X$\stackrel{O_{2}}{→}$Y$\stackrel{O_{2}}{→}$Z$\stackrel{H_{2}O}{→}$W.
| A. | N2 | B. | C | C. | S | D. | Si |
3.胶体区别于其它分散系的本质是( )
| A. | 胶体粒子带电荷并且在一定条件下能稳定存在 | |
| B. | 胶体的分散质粒子直径在1nm~100nm之间 | |
| C. | 胶体粒子不能穿过半透膜,能通过滤纸空隙 | |
| D. | 胶体粒子能够发生布朗运动而且能产生丁达尔现象 |
 ⑤
⑤

 .
.