题目内容
水的电离平衡曲线如图所示,下列说法正确的是( )
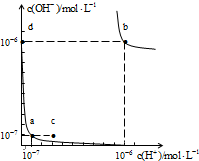

| A、图中对应点的温度关系为:a>b |
| B、水的离子积常数Kw数值大小关系为:b>d |
| C、温度不变,加入少量NaOH可使溶液从a点变到c点 |
| D、在b点对应的温度下,pH=6的溶液显酸性 |
考点:离子积常数,水的电离
专题:电离平衡与溶液的pH专题
分析:水的电离是吸热反应,升高温度促进水电离,水的离子积常数=c(H+).c(OH-),根据图片知,a点水的离子积常数=10-7 mol/L×10-7 mol/L=10-14 (mol/L)2,b点时水的离子积常数=10-6mol/L×10-6 mol/L=10-12 (mol/L)2,据此分析解答.
解答:
解:A.水的电离是吸热反应,升高温度促进水电离,水的离子积常数=c(H+).c(OH-),根据图片知,a点水的离子积常数=10-7 mol/L×10-7 mol/L=10-14 (mol/L)2,b点时水的离子积常数=10-6mol/L×10-6 mol/L=10-12 (mol/L)2,所以温度a<b,故A错误;
B.a、d点水的离子积常数不变,说明温度相等,a点温度小于b,所以水的离子积常数b>d,故B正确;
C.a、c两点温度不同,其离子积常数不同,温度不变,其离子积常数不变,所以加入少量NaOH不能使溶液从a点变到c点,故C错误;
D.在b点对应的温度下,中性溶液中c(H+)=10-6mol/L,pH=6的溶液显中性,故D错误;
故选B.
B.a、d点水的离子积常数不变,说明温度相等,a点温度小于b,所以水的离子积常数b>d,故B正确;
C.a、c两点温度不同,其离子积常数不同,温度不变,其离子积常数不变,所以加入少量NaOH不能使溶液从a点变到c点,故C错误;
D.在b点对应的温度下,中性溶液中c(H+)=10-6mol/L,pH=6的溶液显中性,故D错误;
故选B.
点评:本题考查离子积常数,明确离子积常数只与温度有关,与溶液浓度、溶液酸碱性无关,溶液酸碱性要根据溶液中氢离子浓度和氢氧根离子浓度的相对大小判断,不能根据溶液的pH判断,为易错点.

练习册系列答案
相关题目
用次氯酸钠固体有效的杀灭水中的细菌和病毒,该过程不可能涉及的变化有( )
| A、置换反应 | B、复分解反应 |
| C、电离 | D、水解 |
检验某极稀的溶液中是否含有N03-,正确的操作方法是( )
| A、加入铜屑和浓硫酸后加热 |
| B、加热浓缩后,再加浓硫酸铜片混合共热 |
| C、加热蒸干,再加强热 |
| D、加热蒸干后与浓硫酸.铜片混合共热 |
将氧化铁和氧化铜的混合物a g,加入100mL 2mol?L-1的盐酸溶液中,恰好完全溶解.若将等质量这种混合物在氢气中加热并充分反应,冷却后剩余固体的质量为( )
| A、0.8 a g |
| B、1.6a g |
| C、(a-0.8)g |
| D、(a-1.6)g |
部分弱酸的电离平衡常数如下表:下列选项错误的是( )
| 弱酸 | HA | HB | H2C |
| 电离平衡常数 (25℃) | K=1.77×10-4 | K=4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A、2Bˉ+H2C=2HB+C2- |
| B、2HA+C2-=2Aˉ+H2C |
| C、中和等体积、等pH的HA和HB消耗NaOH的量前者小于后者 |
| D、等体积、等浓度的NaA和NaB溶液中所含离子总数前者大于后者 |
下列变化中,需要加入还原剂才能实现的( )
| A、Cl-→Cl2 |
| B、FeCl3→FeCl2 |
| C、CaCO3→CO2 |
| D、KMnO4→MnO2 |