题目内容
19.根据要求填空(1)键线式
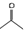 可表示CH3COCH3,则
可表示CH3COCH3,则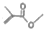 的结构简式:(CH3)2CHCOOCH3
的结构简式:(CH3)2CHCOOCH3(2)写出乙烯分子的电子式:
 .
.(3)
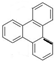 的一氯代物有6种,邻二甲苯苯环上的二氯代物有4种.
的一氯代物有6种,邻二甲苯苯环上的二氯代物有4种.
分析 (1)根据C形成4个化学键、O形成2个化学键分析;
(2)乙烯中有2对共用电子对;
(3)氯取代产物的种类取决于有机物物中氢原子的种类;分子中等效氢原子一般有如下情况:①分子中同一甲基上连接的氢原子等效.②同一碳原子所连的氢原子等效,同一碳原子所连甲基上的氢原子等效.③处于镜面对称位置上的氢原子等效.根据固定一个氯原子的方法来确定另一个氯原子的可能位置,据此分析解答.
解答 解:(1)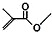 的分子式为:C5H9O2,结构简式为CH2=C(CH3)COOCH3,故答案为:CH2=C(CH3)COOCH3;
的分子式为:C5H9O2,结构简式为CH2=C(CH3)COOCH3,故答案为:CH2=C(CH3)COOCH3;
(2)乙烯中含碳和碳之间以共价双键结合,电子式为 ,故答案为:
,故答案为: ;
;
(3)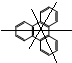 中有2种氢原子,所以
中有2种氢原子,所以 的一氯取代物有2种;邻二甲苯
的一氯取代物有2种;邻二甲苯 的苯环上含有2种等效H,所以其一氯代物有2种,当一个氯原子在甲基的邻位,另一个氯原子有3种位置,当一个氯原子在甲基的间位,另一个氯原子有1种位置,邻二甲苯苯环上的二氯代物有4种,
的苯环上含有2种等效H,所以其一氯代物有2种,当一个氯原子在甲基的邻位,另一个氯原子有3种位置,当一个氯原子在甲基的间位,另一个氯原子有1种位置,邻二甲苯苯环上的二氯代物有4种,
故答案为:6;4.
点评 本题考查了电子式的书写、同分异构数目的判定,题目难度中等,掌握丙同分异构的书写方法,明确电子式的概念及书写原则是解答本题的关键,注意取“代等效氢法”是判断取代物的同分异构体最常用的方法.

练习册系列答案
相关题目
13.下列实验中,操作和现象以及对应结论都正确且现象与结论具有因果关系的是( )
| 序号 | 操作和现象 | 结论 |
| A | 向某溶液中先滴加稀硝酸,再滴加Ba(NO3)2溶液,出现白色沉淀 | 该溶液中一定含有SO42- |
| B | 向某溶液中加入足量浓NaOH溶液并微热,产生能使湿润的红色石蕊试纸变蓝的无色气体 | 该溶液中含NH4+ |
| C | 常温下,测得饱和NaA溶液的pH大于饱和NaB溶液 | 常温下水解程度:A->B- |
| D | 向蔗糖溶液中滴加少量稀H2SO4,水浴加热;向其中滴加少量新制Cu(OH)2悬浊液,加热,无明显现象 | 蔗糖没有水解 |
| A. | A | B. | B | C. | C | D. | D |
7.下列说法正确的是( )
| A. | 浓硫酸被稀释时只有水合过程,所以浓硫酸稀释时放热 | |
| B. | 氯化铵晶体投入水中只有扩散过程,所以氯化铵晶体溶于水吸热 | |
| C. | 烧碱溶于水,溶液温度升高,说明烧碱溶解时水合过程放出的热量大于扩散过程吸收的热量 | |
| D. | 任何物质溶于水,要么温度升高,要么温度下降 |
4.X、Y、Z、R是短周期主族元素,X原子最外层电子数是次外层的两倍,Y元素在地壳中的含量最多,Z元素的化合物的焰色反应呈黄色,R原子的核外电子数是X原子与Z原子的核外电子数之和.下列叙述正确的是( )
| A. | X与Y能形成两种常见的气态化合物 | |
| B. | 原子半径的大小顺序:r(X)>r(Y)>r(Z)>r(R) | |
| C. | X、Z分别与R形成的化合物中化学键类型相同 | |
| D. | 含有Y、Z、R三种元素的化合物最多只有2种 |
11.下列物质中,既含有离子键又含有非极性共价键的是( )
| A. | H2S | B. | CO2 | C. | K2O2 | D. | Na2CO3 |
8.下列结论正确的是
①微粒半径:S2->Cl->F ②氢化物的稳定性:HF>HCl>H2S>H2Te
③离子的还原性:S2->Cl->Br->I- ④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>HClO4>H2SeO4 ⑥非金属性:F>Cl>S>Se( )
①微粒半径:S2->Cl->F ②氢化物的稳定性:HF>HCl>H2S>H2Te
③离子的还原性:S2->Cl->Br->I- ④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>HClO4>H2SeO4 ⑥非金属性:F>Cl>S>Se( )
| A. | ①②④⑥ | B. | ①③④ | C. | ①③ | D. | ⑤⑥ |
9.有机物 的一氯代物的同分异构体有几种?( )
的一氯代物的同分异构体有几种?( )
 的一氯代物的同分异构体有几种?( )
的一氯代物的同分异构体有几种?( )| A. | 7 | B. | 8 | C. | 9 | D. | 10 |
 今有正反应放热的可逆反应,若反应开始经t1后达平衡,在t2时由于反应条件改变,使平衡破坏,到t3时又达平衡,如图所示.
今有正反应放热的可逆反应,若反应开始经t1后达平衡,在t2时由于反应条件改变,使平衡破坏,到t3时又达平衡,如图所示.