题目内容
14.铁、铝、铜及其化合物在生产、生活中有广泛的用途,试回答下列问题:(1)制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,请写出该反应的离子方程式2Fe3++Cu=2Fe2++Cu2+;
(2)已知铜与稀硫酸不反应,但将铜片在稀硫酸中长时间加热时溶液会呈蓝色,请用化学方程式表示原
因2Cu+O2+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O.
(3)氯化铝广泛用于有机合成和石油工业的催化剂.将铝土矿粉(主要成分为Al2O3)与焦炭混合后加热并
通入氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式2Cu+O2+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O
(4)已知Cu2S可以和硝酸反应,请配平下列化学反应方程式:
3Cu2S+16HNO3 $\frac{\underline{\;\;△\;\;}}{\;}$3CuSO4+3Cu(NO3)2+10NO↑+8H2O
(5)某校兴趣小组欲测定一种铁铝硅合金(FexAlySiz)粉末的组成,提出如下方案:准确称取1.46g该合金粉末,加入过量盐酸溶液充分反应后过滤,测定剩余固体质量0.07g.向滤液中滴加足量浓NaOH溶液,充分搅拌、过滤、洗涤得固体.再将所得固体充分加热、灼烧得红棕色粉末1.60g,通过计算确定此合金的组成为Fe8Al4Si(填化学式).
分析 (1)氯化铁和铜反应生成氯化亚铁和氯化铜,依据离子方程式书写方法写出;
(2)铜片在稀硫酸中长时间加热时溶液会呈蓝色是因为铜和氧气反应生成氧化铜与稀硫酸反应生成硫酸铜溶液呈蓝色;
(3)根据反应物、生成物和反应条件写出配平反应方程式;
(4)Cu2S中两种元素化合价都变,可将其作一整体,然后运用守恒的思想配平;
(5)合金溶于过量盐酸铁和铝反应,剩余固体质量为硅的质量,计算得到n(Si),加入过量氢氧化钠溶液铝离子反应全部变化为偏铝酸钠,铁离子生成氢氧化铁过滤、洗涤得固体.再将所得固体充分加热、灼烧,得红棕色粉末1.60g为Fe2O3,计算得到铁元素物质的量,结合质量守恒计算合金中铝元素物质的量得到化学式;
解答 解:(1)FeCl3蚀刻铜箔反应是三价铁离子具有氧化性和铜反应生成亚铁离子和铜离子,反应的离子方程式为:2Fe3++Cu=2Fe2++Cu2+,
故答案为:2Fe3++Cu=2Fe2++Cu2+;
(2)因溶液中有氧气,加热能与铜反应生成氧化铜:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,氧化铜再与硫酸反应:CuO+H2SO4=CuSO4+H2O,两式相加:2Cu+O2+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O,
故答案为:2Cu+O2+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O;
(3)根据题意知,反应物是氧化铝、碳和氯气,反应条件是加热,生成物是氯化铝和一氧化碳,所以其反应方程式为:Al2O3+3C+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2AlCl3+3CO,
故答案为:Al2O3+3Cl2+3C$\frac{\underline{\;\;△\;\;}}{\;}$2AlCl3+3CO;
(4)在Cu2S中:
Cu+1→+2↑(2-1)×2
S-2→+6-(-2)
化合价升高10
而HNO3中N+5→+2化合价降低3,根据化合价的升降守恒:
3Cu2S+□HNO3$\frac{\underline{\;\;△\;\;}}{\;}$□CuSO4+□Cu(NO3)2+10NO↑+( )
再根据原子守恒得:
S守恒:3Cu2S+□HNO3$\frac{\underline{\;\;△\;\;}}{\;}$3CuSO4+□Cu(NO3)2+10NO↑+( )
Cu守恒:3Cu2S+□HNO3$\frac{\underline{\;\;△\;\;}}{\;}$3CuSO4+3Cu(NO3)2+10NO↑+( )
N守恒:3Cu2S+16HNO3$\frac{\underline{\;\;△\;\;}}{\;}$3CuSO4+3Cu(NO3)2+10NO↑+( )
质量守恒得:3Cu2S+16HNO3$\frac{\underline{\;\;△\;\;}}{\;}$3CuSO4+3Cu(NO3)2+10NO↑+8 H2O
故答案为:3Cu2S+16HNO3$\frac{\underline{\;\;△\;\;}}{\;}$3CuSO4+3Cu(NO3)2+10NO↑+8H2O;
(5)准确称取1.46g该合金粉末,加入过量盐酸溶液,充分反应后过滤,铁和铝全部溶解,测定剩余固体质量0.07g为硅.n(Si)=$\frac{0.07g}{28g/mol}$=0.0025mol,向滤液中滴加足量NaOH浓溶液,铝离子反应生成偏铝酸钠,充分搅拌、过滤、洗涤得固体.判断为Fe(OH)3,再将所得固体充分加热、灼烧,得红棕色粉末1.60g为Fe2O3,铁的物质的量n(Fe)=$\frac{1.60g}{160g/mol}$×2=0.02mol,n(Al)=$\frac{1.46g-0.07g-0.02mol×56g/mol}{27g/mol}$=0.01mol;n(Fe):n(Al):n(Si)=0.02:0.01:0.0025=8:4:1,所以化学式为:Fe8Al4Si,
故答案为:Fe8Al4Si.
点评 本题考查了铁离子的氧化性,提取铜的反应过程和步骤分析判断,氢氧化铁氢氧化亚铁的转化反应,溶度积的计算应用,题目难度中等.

| A. | 常温下,将pH=10的氨水溶液稀释到原体积的10倍后,溶液的pH=9 | |
| B. | 25℃时,分别向体积均为10mL pH=3的HCl和pH=3的CH3COOH溶液中,滴加0.1mol•L-1的NaOH溶液,至中性时,盐酸消耗的氢氧化钠体积多 | |
| C. | 向0.05mol•L-1的Na2CO3溶液中加入0.05mol CaO,溶液中$\frac{c(O{H}^{-})}{c(HC{{O}_{3}}^{-})}$减小 | |
| D. | 25℃时氯气-氯水体系汇总存在以下平衡关系:c(H+)-c(OH-)=2c(ClO-)+c(HClO) |
| A. | b-a=m+n | B. | a+b=m+n | C. | a-b=m-n | D. | a-b=m+n |
| A. | d元素的非金属性最强 | |
| B. | 它们均存在两种或两种以上的氧化物 | |
| C. | 只有a与其他元素生成的化合物都是离子化合物 | |
| D. | a.b.c.d与氢形成的化合物中化学键均为极性共价键 |
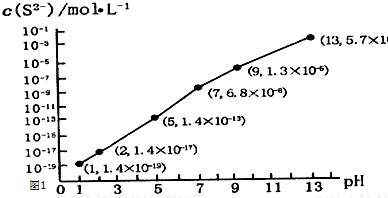
(1)测得Na2SO3溶液pH=10,AgNO3溶液pH=5,二者发生水解的离子分别是SO32-、Ag+.
(2)调节pH,实验记录如下:
| 实验 | pH | 现象 |
| A | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| B | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
①Ag2SO3:白色,难溶于水,溶于过量Na2SO3的溶液
②Ag2O:棕黑色,不溶于水,能和酸反应,它和盐酸反应的化学方程式为:Ag2O+2HCl=2AgCl+H2O.
(3)该同学推测a中白色沉淀为Ag2SO4,依据是空气中的氧气可能参与反应,则生成硫酸银沉淀的离子方程式为2Ag++O2+2SO32-=Ag2SO4↓+SO42-.
该同学设计实验确认了a、b、c中的白色沉淀不是Ag2SO4,实验方法是:取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解.另取Ag2SO4固体置于足量Na2SO3溶液中,未溶解.
(4)将c中X滤出、洗净,为确认其组成,实验如下:
I.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体
Ⅲ.用Ba(NO3)2溶液、BaCl2溶液检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀
①实验I的目的是证明X不是Ag2O.
②根据实验现象,分析X是Ag.
③Ⅱ中反应的化学方程式是Ag+2HNO3(浓)=AgNO3+NO2↑+H2O.
(5)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强.+4价硫的还原性增强,能被+1价银氧化.通过进一步实验确认了这种可能性,实验如下:
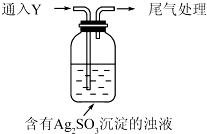
①通入Y后,瓶中白色沉淀转化为棕黑色,气体Y是SO2.
②白色沉淀转化为X的化学方程式是Ag2SO3+H2O$\frac{\underline{\;H+\;}}{\;}$2Ag+H2SO4.
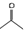 可表示CH3COCH3,则
可表示CH3COCH3,则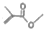 的结构简式:(CH3)2CHCOOCH3
的结构简式:(CH3)2CHCOOCH3 .
.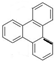 的一氯代物有6种,邻二甲苯苯环上的二氯代物有4种.
的一氯代物有6种,邻二甲苯苯环上的二氯代物有4种.