题目内容
7.A~E等几种烃分子的球棍模型如下图所示,据此回答下列问题.
C的化学式为C2H4.
分析 根据球棍模型可知,A为甲烷,B为乙烷,C为乙烯,D为乙炔,E为丙烷,据此分析.
解答 解:根据球棍模型可知,A为甲烷,B为乙烷,C为乙烯,D为乙炔,E为丙烷,故C的化学式为C2H4,故答案为:C2H4.
点评 本题考查了有机物结构、球棍模型的表示方法,题目难度中等,注意掌握常见有机物结构与性质,明确球棍模型表示的意义是解答本题关键.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
18.苹果酸结构简式为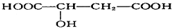 ,苹果酸可能发生的反应是( )
,苹果酸可能发生的反应是( )
①与NaOH溶液反应
②与石蕊试液作用变红
③与金属钠反应放出气体
④一定条件下能发生消去反应
⑤一定条件下能发生氧化反应.
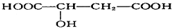 ,苹果酸可能发生的反应是( )
,苹果酸可能发生的反应是( )①与NaOH溶液反应
②与石蕊试液作用变红
③与金属钠反应放出气体
④一定条件下能发生消去反应
⑤一定条件下能发生氧化反应.
| A. | ①②③ | B. | ①②③④ | C. | ①②③⑤ | D. | ①②③④⑤ |
2.羟基扁桃酸是药物合成的重要中间体,它可由苯酚和乙醛酸反应制得,下列有关说法正确的是( )
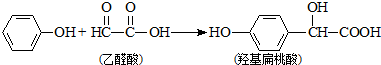
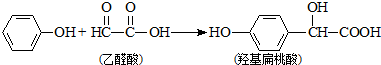
| A. | 苯酚和羟基扁桃酸互为同系物 | |
| B. | 常温下,1mol羟基扁桃酸只能与2molBr2反应发生加成反应 | |
| C. | 羟基扁桃酸分子中至少有12个原子共平面 | |
| D. | 乙醛酸的核磁共振氢谱中只有1个吸收峰 |
19.工业上以锂辉石(Li2O•Al2O3•4SiO2,含少量Ca,Mg元素)为原料生产碳酸锂.其部分工业流程如图:
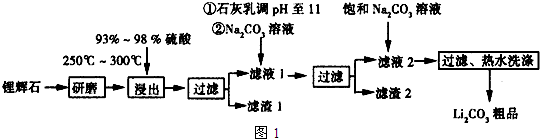
已知:①Li2O•Al2O3•4SiO2+H2SO4(浓)$\frac{\underline{\;250~300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O
②某些物质的溶解度(S)如表所示.
(1)从滤渣1中分离出Al2O3部分的流程如图2所示,括号表示加入的试剂,方框表示所得的物质.则步骤Ⅱ中反应的离子方程式是Al3++3NH3•H2O=Al(OH)3↓+3NH4+
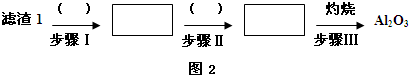
请写出Al2O3和Na2CO3固体在高温下反应的化学方程式Al2O3+Na2CO3$\frac{\underline{\;高温\;}}{\;}$2NaAlO2+CO2.
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3.向滤液1中加入石灰乳的作用是(运用化学平衡原理简述)Ca(OH)2?Ca2++2OH-,Mg2+与OH-结合生成Ksp很小的Mg(OH)2沉淀,导致平衡右移,生成Mg(OH)2沉淀.
(3)最后一个步骤中,用“热水洗涤”的原因是减少Li2CO3的损失.
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液做阴极液,两者用离子选择透过膜隔开,用惰性电极电解.
b.电解后向LiOH溶液中加入少量NH4HCO3溶液并共热,过滤、烘干得高纯Li2CO3.
①a中,阳极的电极反应式是2C1--2e-=Cl2↑.
②b中,生成Li2CO3反应的化学方程式是2LiOH+NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$Li2CO3+NH3+2H2O.

已知:①Li2O•Al2O3•4SiO2+H2SO4(浓)$\frac{\underline{\;250~300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O
②某些物质的溶解度(S)如表所示.
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |

请写出Al2O3和Na2CO3固体在高温下反应的化学方程式Al2O3+Na2CO3$\frac{\underline{\;高温\;}}{\;}$2NaAlO2+CO2.
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3.向滤液1中加入石灰乳的作用是(运用化学平衡原理简述)Ca(OH)2?Ca2++2OH-,Mg2+与OH-结合生成Ksp很小的Mg(OH)2沉淀,导致平衡右移,生成Mg(OH)2沉淀.
(3)最后一个步骤中,用“热水洗涤”的原因是减少Li2CO3的损失.
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液做阴极液,两者用离子选择透过膜隔开,用惰性电极电解.
b.电解后向LiOH溶液中加入少量NH4HCO3溶液并共热,过滤、烘干得高纯Li2CO3.
①a中,阳极的电极反应式是2C1--2e-=Cl2↑.
②b中,生成Li2CO3反应的化学方程式是2LiOH+NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$Li2CO3+NH3+2H2O.

 维生素C的结构简式如图:其分子式为C6H8O6,所含的官能团是醇羟基、碳碳双键和酯基,判断维生素C能(填“能”或“否”)溶于水.
维生素C的结构简式如图:其分子式为C6H8O6,所含的官能团是醇羟基、碳碳双键和酯基,判断维生素C能(填“能”或“否”)溶于水.