题目内容
2.25℃时,50mL0.1mol/L醋酸中存在下述平衡:CH3COOH?CH3COO-+H+若分别作如下改变,对上述平衡有何影响?
(1)加入少量冰醋酸,平衡将向电离方向移动,溶液中c(H+)将增大(增大、减小、不变);
(2)加入一定量蒸馏水,平衡将向电离方向移动,溶液中c(H+)将减小(增大、减小、不变)
(3)加入少量0.1mol/L盐酸,平衡将向离子结合成分子的方向移动,溶液中c(H+)将增大(增大、减小、不变)
(4)加入20mL0.10mol/LNaCl溶液,平衡将向电离方向移动,溶液中c(H+)将减小(增大、减小、不变)
分析 CH3COOH是弱电解质,部分电离生成CH3COO-、H+;
(1)加入冰醋酸,醋酸浓度增大平衡向正反应方向移动;
(2)浓度越小其电离程度越大;但其电离增大程度小于溶液体积增大程度;
(3)HCl电离出的氢离子抑制醋酸电离;
(4)加入氯化钠溶液相当于稀释醋酸,促进醋酸电离.
解答 解:CH3COOH是弱电解质,部分电离生成CH3COO-、H+,电离方程式为CH3COOH?CH3COO-+H+,
故答案为:CH3COOH?CH3COO-+H+;
(1)加入冰醋酸,醋酸浓度增大平衡向正反应方向移动,导致溶液中c(H+)增大,
故答案为:向电离方向移动;增大;
(2)浓度越小其电离程度越大,所以加水稀释促进醋酸电离,平衡向电离方向移动;但其电离增大程度小于溶液体积增大程度,导致溶液中c(H+)减小,
故答案为:向电离方向移动;减小;
(3)HCl电离出的氢离子抑制醋酸电离,所以抑制醋酸电离,则醋酸向离子结合成分子的方向移动,但溶液中c(H+)增大,
故答案为:向离子结合成分子的方向移动;增大;
(4)加入氯化钠溶液相当于稀释醋酸,促进醋酸电离,则醋酸向电离方向移动,因为醋酸电离增大程度小于溶液体积增大程度,所以c(H+)减小,故答案为:向电离方向移动;减小.
点评 本题考查弱电解质的电离,为高频考点,明确弱电解质电离特点及电离影响因素是解本题关键,知道弱电解质电离程度与其浓度关系,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.下列物质中,不能直接用单质反应制得的是( )
| A. | CuCl2 | B. | SO3 | C. | FeCl3 | D. | NO2 |
11.关于下列装置说法正确的是( )
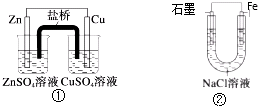

| A. | 装置②中的Fe发生析氢腐蚀 | |
| B. | 装置①中,Zn为负极,发生还原反应 | |
| C. | 装置①中,盐桥中的K+移向CuSO4溶液 | |
| D. | 装置②中电子由Fe流向石墨,然后再经溶液流向Fe |
11.下列事实能判断金属元素甲的金属性一定比乙的金属性强的有( )
①甲单质能与乙的盐溶液反应
②甲、乙两元素原子的最外层电子数相同,且甲的原子半径小于乙的原子半径
③甲、乙两短周期元素原子的电子层数相同,且甲的原子序数小于乙的原子序数
④两单质分别与氯气反应时生成的阳离子,甲失去的电子数比乙失去的电子数多.
①甲单质能与乙的盐溶液反应
②甲、乙两元素原子的最外层电子数相同,且甲的原子半径小于乙的原子半径
③甲、乙两短周期元素原子的电子层数相同,且甲的原子序数小于乙的原子序数
④两单质分别与氯气反应时生成的阳离子,甲失去的电子数比乙失去的电子数多.
| A. | 全部可以 | B. | 仅②不可以 | C. | 仅②④不可以 | D. | 仅③可以 |
12.下列化学用语的书写,不正确的是( )
| A. | 溴化钠的电子式: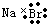 | B. | 硫原子的结构示意图: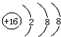 | ||
| C. | 氢气分子的电子式: | D. | 水的分子式为H2O |

 的物质,该物质是一种香料.
的物质,该物质是一种香料.
 、
、 .
. 的官能团的名称醛基.
的官能团的名称醛基. .
. .
.
 .
.