题目内容
3.100mLMgCl2溶液中有Mg2+0.1mol,对该溶液的说法不正确的是( )| A. | 该溶液的物质的量浓度为1mol•L-1 | |
| B. | 配置该溶液需用MgCl29.5g | |
| C. | 该溶液与200mL1mol•L-1NaCl溶液的Cl-的物质的量浓度相同 | |
| D. | 取10mL该溶液再稀至100mL,所得溶液的Cl-的物质的量为0.02mol |
分析 A.根据镁守恒可知n(MgCl2)=n(Mg2+)=0.1mol,利用c=$\frac{n}{V}$解答;
B.根据镁守恒可知n(MgCl2)=n(Mg2+)=0.1mol,利用m=nM解答;
C.同一化学式中各微粒的浓度等于物质的物质的量浓度×离子个数,与溶液的体积无关;
D.稀释前后溶质的物质的量不变.
解答 解:A.由镁守恒可知n(MgCl2)=n(Mg2+)=0.1mol,物质的量浓度为c=$\frac{0.1mol}{0.1L}$=1mol•L-1,故A正确;
B.由镁守恒可知n(MgCl2)=n(Mg2+)=0.1mol,m=0.1mol×95g/mol=9.5g,故B正确;
C.溶液的物质的量浓度为c(MgCl2)=$\frac{0.1mol}{0.1L}$=1mol•L-1,Cl-的物质的量浓度c(Cl-)=2c(MgCl2)=2mol•L-1;200mL1mol•L-1NaCl溶液的Cl-的物质的量浓度c(Cl-)=c(NaCl)=1mol•L-1,故C错误;
D.取10mL该溶液,溶液中含有n(MgCl2)=0.01mol,Cl-的物质的量为0.02mol,再稀至100mL,所得溶液的Cl-的物质的量为0.02mol,故D正确;
故选C.
点评 本题考查了物质的量浓度的计算,题目难度不大,试题侧重基础知识的考查,注意掌握物质的量浓度的概念及计算方法.

练习册系列答案
 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
18.下列说法正确的是( )
| A. | 淀粉、纤维素、油脂、蛋白质都属于天然高分子形成的混合物 | |
| B. | 葡萄糖溶液中加入新制Cu(OH)2悬浊液煮沸会析出红色沉淀 | |
| C. | 氨基酸有两性,其脱水缩合得到的蛋白质就不再有两性 | |
| D. | 纤维素、淀粉都可用(C6H10O5)n表示,但它们并不为同分异构体 |
8.乙烷在光照的条件下与氯气混和,共可以生成几种物质( )
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
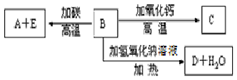 A、B、C、D、E代表单质或化合物,它们之间的相互转换关系如图所示.A为地壳中含量仅次于氧的非金属元素的单质.
A、B、C、D、E代表单质或化合物,它们之间的相互转换关系如图所示.A为地壳中含量仅次于氧的非金属元素的单质. 某研究性学习小组根据老师的学案设计实验对碳酸钠和碳酸氢钠的性质进行研究.
某研究性学习小组根据老师的学案设计实验对碳酸钠和碳酸氢钠的性质进行研究. 2Z(g),X2、Y2、Z的起始浓度分别为0.1mol·L-1、0.3 mol·L-1、0.2 mol·L-1。在一定条件下,当反应达到平衡时,各物质的浓度可能是
2Z(g),X2、Y2、Z的起始浓度分别为0.1mol·L-1、0.3 mol·L-1、0.2 mol·L-1。在一定条件下,当反应达到平衡时,各物质的浓度可能是