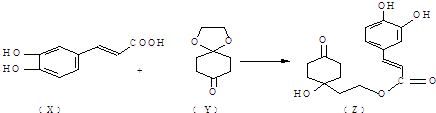
题目内容
下列有关化学用语表示正确的是( )
| A、二氧化硅的分子式 SiO2 | ||
| B、氧化铁的化学式:FeO | ||
C、次氯酸的电子式 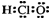 | ||
D、中子数为78的碘原子:
|
考点:电子式、化学式或化学符号及名称的综合
专题:化学用语专题
分析:A.二氧化硅为原子晶体,不存在分子式,SiO2为二氧化硅的化学式;
B.氧化铁中铁元素为+3价,即为铁离子,不是亚铁离子;
C.次氯酸中不存在氢氯键,其分子中存在1个氧氢键和1个氧氯键;
D.碘元素的核电荷数为53,该碘原子的中子数为131.
B.氧化铁中铁元素为+3价,即为铁离子,不是亚铁离子;
C.次氯酸中不存在氢氯键,其分子中存在1个氧氢键和1个氧氯键;
D.碘元素的核电荷数为53,该碘原子的中子数为131.
解答:
解:A.二氧化硅晶体为原子晶体,原子晶体中不存在分子,SiO2为二氧化硅的化学式,故A错误;
B.氧化铁为三氧化二铁,其化学式为:Fe2O3,FeO为氧化亚铁,故B错误;
C.次氯酸为共价化合物,分子中不存在氢氯键,次氯酸的电子式为: ,故C错误;
,故C错误;
D.碘元素的质子数为53,中子数为78的碘原子的可以表示为:
I,故D正确;
故选D.
B.氧化铁为三氧化二铁,其化学式为:Fe2O3,FeO为氧化亚铁,故B错误;
C.次氯酸为共价化合物,分子中不存在氢氯键,次氯酸的电子式为:
 ,故C错误;
,故C错误;D.碘元素的质子数为53,中子数为78的碘原子的可以表示为:
131 53 |
故选D.
点评:本题考查了分子式与化学式的书写判断、电子式、核素的表示方法,题目难度中等,注意掌握常见化学用语的表示方法,明确原子晶体、离子晶体中不存在分子.

练习册系列答案
相关题目
下列叙述中,金属a的活泼性肯定比金属b的活泼性强的是( )
| A、a原子的最外层电子数比b原子的最外层电子数少 |
| B、把a、b两块金属片浸入稀硫酸中,用导线相连组成原电池时,电流由 a到b |
| C、1mol a从酸中置换H+生成的H2比1mol b从酸中置换H+生成的H2多 |
| D、常温时,a能从水中置换出氢,而b不能 |
下列有关碱金属的叙述正确的是( )
| A、碱金属都可以保存在煤油中 |
| B、碱金属的金属性强弱为:Li<Na<K<Rb |
| C、随着原子序数的增加,碱金属的熔点增大 |
| D、碱金属着火应用泡沫灭火剂更好 |
下列叙述中正确的是( )
| A、金属钠在氯气中燃烧会产生棕黄色烟 |
| B、漂粉精在空气中容易失效的原因是次氯酸钙不稳定,易分解 |
| C、氯水经光照后产生的气体是挥发的氯气 |
| D、常温下1体积水中能溶解2体积Cl2,所以饱和氯水是稀溶液 |
等物质的量的下列各有机物完全燃烧,生成CO2和H2O,耗氧量最多的是( )
| A、CH4O |
| B、C2H4O2 |
| C、C6H6 |
| D、C4H10 |
现将5.6g铁粉和硫粉在隔绝空气的条件下加热反应后,在其固体中加入足量的稀硫酸,产生0.1mol气体,反应前硫粉的质量为( )
| A、大于3.2 g |
| B、等于3.2 g |
| C、小于3.2 g |
| D、任意质量 |
下列关于F、Cl、Br、I性质的比较,不正确的是( )
| A、它们的氢化物的稳定性随核电荷数的增加而增强 |
| B、它们单质的氧化性依次减弱 |
| C、它们的原子核外电子层数随核电荷数的增加而增多 |
| D、单质的颜色随核电荷数的增加而加深 |
关于12C、14C、13N、14N几种原子的相互关系描述正确的是( )
| A、14C和14N质量数相同,互为同位素 |
| B、12C和14N含有相同的中子数 |
| C、12C和13N中子数相同,质子数不同,互为同位素 |
| D、12CO和14CO物理性质不同,化学性质基本相同 |