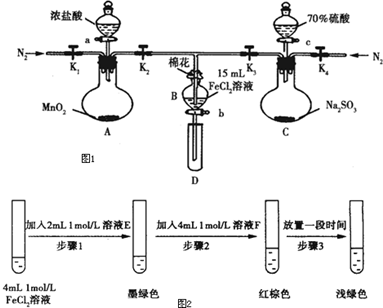
题目内容
下列关于F、Cl、Br、I性质的比较,不正确的是( )
| A、它们的氢化物的稳定性随核电荷数的增加而增强 |
| B、它们单质的氧化性依次减弱 |
| C、它们的原子核外电子层数随核电荷数的增加而增多 |
| D、单质的颜色随核电荷数的增加而加深 |
考点:卤素原子结构及其性质的比较
专题:元素周期律与元素周期表专题
分析:A、同主族,从上到下,元素氢化物的稳定性逐渐减弱;
B、同主族,从上到下,单质的氧化性逐渐减弱;
C、同主族,从上到下,元素原子的电子层数依次增多;
D、卤素单质的颜色从上到下逐渐加深.
B、同主族,从上到下,单质的氧化性逐渐减弱;
C、同主族,从上到下,元素原子的电子层数依次增多;
D、卤素单质的颜色从上到下逐渐加深.
解答:
解:A、按照F、Cl、Br、I的顺序,核电核数逐渐增加,它们的氢化物的稳定性逐渐减弱,故A错误;
B、F、Cl、Br、I的核电核数逐渐增多,单质的氧化性逐渐减弱,故B正确;
C、F、Cl、Br、I的原子核外电子层数随核电核数的增加而增多,故C正确;
D、F2、Cl2、Br2、I2单质的颜色分别是浅黄绿色、黄绿色、深红棕色和紫黑色,即其颜色逐渐加深,故D正确.
故选A.
B、F、Cl、Br、I的核电核数逐渐增多,单质的氧化性逐渐减弱,故B正确;
C、F、Cl、Br、I的原子核外电子层数随核电核数的增加而增多,故C正确;
D、F2、Cl2、Br2、I2单质的颜色分别是浅黄绿色、黄绿色、深红棕色和紫黑色,即其颜色逐渐加深,故D正确.
故选A.
点评:本题结合卤族元素考查学生元素周期律的知识,可以根据教材知识来回答,难度不大.

练习册系列答案
相关题目
X、Y、Z、M、N代表五种金属,有以下反应:
①Y与M用导线连接放入稀硫酸中,M上冒气泡;
②M、N为电极,与N的盐溶液组成原电池,电子从M极流出,经过外电路,流入N极;
③Z+2H2O(冷水)═Z(OH)2+H2↑;
④水溶液中,X+Y2+═X2++Y.
则这五种金属的活动性由强到弱的顺序为( )
①Y与M用导线连接放入稀硫酸中,M上冒气泡;
②M、N为电极,与N的盐溶液组成原电池,电子从M极流出,经过外电路,流入N极;
③Z+2H2O(冷水)═Z(OH)2+H2↑;
④水溶液中,X+Y2+═X2++Y.
则这五种金属的活动性由强到弱的顺序为( )
| A、Z>X>Y>M>N |
| B、Z>Y>X>M>N |
| C、Z>X>Y>N>M |
| D、X>Y>M>N>Z |
下列各组物质中,全部属于纯净物的一组是( )
| A、福尔马林、白酒、醋 |
| B、甘油、冰醋酸、煤 |
| C、苯、汽油、无水酒精 |
| D、丙三醇、氯仿、乙醇钠 |
下列有关化学用语表示正确的是( )
| A、二氧化硅的分子式 SiO2 | ||
| B、氧化铁的化学式:FeO | ||
C、次氯酸的电子式 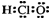 | ||
D、中子数为78的碘原子:
|
下列说法中错误的是( )
| A、需要加热才能发生的反应一定是吸热反应 |
| B、化学键的断裂和形成是化学反应中能量变化的主要原因 |
| C、反应物总能量和生成物总能量的相对大小决定了反应是放出能量还是吸收能量 |
| D、化学反应中的能量变化通常表象为热量的变化 |
与Li<Na<K<Rb<Cs的变化规律不符合的是( )
| A、与水或酸反应置换氢气越来越剧烈 |
| B、对应元素的金属性由弱到强 |
| C、对应金属阳离子氧化性由弱到强 |
| D、原子半径由小到大 |
下列元素中,不属于主族元素的是( )
| A、磷 | B、钙 | C、铁 | D、溴 |
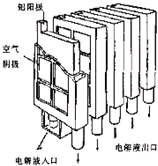 近年来,金属-空气电池的研究和应用取得很大进步这种新型燃料电池具有比能量高、对环境友好、应用场合多等多方面优点.铝-空气电池工作原理如图所示.关于金属-空气电池的说法不正确的是( )
近年来,金属-空气电池的研究和应用取得很大进步这种新型燃料电池具有比能量高、对环境友好、应用场合多等多方面优点.铝-空气电池工作原理如图所示.关于金属-空气电池的说法不正确的是( )| A、铝-空气电池(如图)中,铝作负极,电子通过外电路到正极 |
| B、为帮助电子与空气中的氧气反应,可使用活性炭作正极材料 |
| C、碱性溶液中,负极反应为Al(s)+3OH-(aq)═Al(OH)3(s)+3e-,每消耗2.7g Al(s),需耗氧6.72L(标准状况) |
| D、金属-空气电池的可持续应用要求是一方面在工作状态下要有足够的氧气供应,另一方面在非工作状态下能够密封防止金属自腐蚀 |