题目内容
下列有关碱金属的叙述正确的是( )
| A、碱金属都可以保存在煤油中 |
| B、碱金属的金属性强弱为:Li<Na<K<Rb |
| C、随着原子序数的增加,碱金属的熔点增大 |
| D、碱金属着火应用泡沫灭火剂更好 |
考点:碱金属的性质
专题:元素周期律与元素周期表专题
分析:A.锂的密度比煤油的密度小;
B.依据同主族元素性质的递变规律解答;
C.金属晶体中金属原子半径越大,金属键越弱,熔点越低;
D.碱金属着火时,与空气中的氧气反应生成的过氧化物或者超氧化物与水、二氧化碳反应生成助燃气体氧气,而泡沫灭火器灭火时产生大量二氧化碳.
B.依据同主族元素性质的递变规律解答;
C.金属晶体中金属原子半径越大,金属键越弱,熔点越低;
D.碱金属着火时,与空气中的氧气反应生成的过氧化物或者超氧化物与水、二氧化碳反应生成助燃气体氧气,而泡沫灭火器灭火时产生大量二氧化碳.
解答:
解:A.锂的密度比煤油的密度小,浮在煤油表面上,起不到隔绝空气的作用,故A错误;
B.依据同主族元素从上到下,金属性依次增强,可知碱金属的金属性强弱为:Li<Na<K<Rb,故B正确;
C.随着原子序数的增加,碱金属原子的半径依次增大,金属键依次越弱,熔点依次降低,故C错误;
D.碱金属着火时,与空气中的氧气反应生成过氧化物或者超氧化物,与水、二氧化碳反应生成助燃气体氧气,而泡沫灭火器灭火时产生大量二氧化碳,所以碱金属着火不能用泡沫灭火器.
故选:B.
B.依据同主族元素从上到下,金属性依次增强,可知碱金属的金属性强弱为:Li<Na<K<Rb,故B正确;
C.随着原子序数的增加,碱金属原子的半径依次增大,金属键依次越弱,熔点依次降低,故C错误;
D.碱金属着火时,与空气中的氧气反应生成过氧化物或者超氧化物,与水、二氧化碳反应生成助燃气体氧气,而泡沫灭火器灭火时产生大量二氧化碳,所以碱金属着火不能用泡沫灭火器.
故选:B.
点评:本题考查碱金属性质的递变规律,题目难度不大,依据周期表中同主族元素性质的递变规律解答,注意D为易错选项,解题关键在于明确泡沫灭火器的原理和碱金属的性质.

练习册系列答案
相关题目
同周期的X、Y、Z三种元素,已知其最高价氧化物对应的水化物的酸性强弱顺序是:HXO4>H2YO4>H3ZO4,则下列各判断中正确的是( )
| A、原子半径:X>Y>Z |
| B、元素的非金属性:X>Y>Z |
| C、气态氢化物稳定性:X<Y<Z |
| D、原子序数:Z>Y>X |
X、Y、Z、M、N代表五种金属,有以下反应:
①Y与M用导线连接放入稀硫酸中,M上冒气泡;
②M、N为电极,与N的盐溶液组成原电池,电子从M极流出,经过外电路,流入N极;
③Z+2H2O(冷水)═Z(OH)2+H2↑;
④水溶液中,X+Y2+═X2++Y.
则这五种金属的活动性由强到弱的顺序为( )
①Y与M用导线连接放入稀硫酸中,M上冒气泡;
②M、N为电极,与N的盐溶液组成原电池,电子从M极流出,经过外电路,流入N极;
③Z+2H2O(冷水)═Z(OH)2+H2↑;
④水溶液中,X+Y2+═X2++Y.
则这五种金属的活动性由强到弱的顺序为( )
| A、Z>X>Y>M>N |
| B、Z>Y>X>M>N |
| C、Z>X>Y>N>M |
| D、X>Y>M>N>Z |
若NA表示阿佛加德罗常数,下列说法正确的是( )
| A、NA个二氧化碳分子和0.5 mol甲烷的质量比为l l:4 |
| B、1molCl2体积约为22.4L |
| C、在0℃,101kPa时,11.2 L氢气中含有0.5NA个氢原子 |
| D、14 g氮气中含有7NA个电子 |
下列表示对应化学反应的离子方程式正确的是( )
| A、用NaClO除去水体中CO(NH2)2产生CO2和N2,3ClO-+CO(NH2)2═3Cl-+CO2↑+N2↑+2H2O |
| B、过氧化氢能使酸性KMnO4溶液褪色:3H2O2+2MnO4-+6H+═2Mn2++4O2↑+6H2O |
| C、用小苏打治疗胃酸过多:CO32-+2H+═CO2↑+H2O |
| D、向Ba(OH)2溶液中逐滴加入溶液恰好沉淀完全:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
下列各组物质中,全部属于纯净物的一组是( )
| A、福尔马林、白酒、醋 |
| B、甘油、冰醋酸、煤 |
| C、苯、汽油、无水酒精 |
| D、丙三醇、氯仿、乙醇钠 |
下列有关化学用语表示正确的是( )
| A、二氧化硅的分子式 SiO2 | ||
| B、氧化铁的化学式:FeO | ||
C、次氯酸的电子式 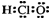 | ||
D、中子数为78的碘原子:
|
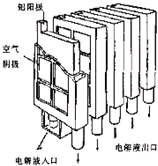 近年来,金属-空气电池的研究和应用取得很大进步这种新型燃料电池具有比能量高、对环境友好、应用场合多等多方面优点.铝-空气电池工作原理如图所示.关于金属-空气电池的说法不正确的是( )
近年来,金属-空气电池的研究和应用取得很大进步这种新型燃料电池具有比能量高、对环境友好、应用场合多等多方面优点.铝-空气电池工作原理如图所示.关于金属-空气电池的说法不正确的是( )| A、铝-空气电池(如图)中,铝作负极,电子通过外电路到正极 |
| B、为帮助电子与空气中的氧气反应,可使用活性炭作正极材料 |
| C、碱性溶液中,负极反应为Al(s)+3OH-(aq)═Al(OH)3(s)+3e-,每消耗2.7g Al(s),需耗氧6.72L(标准状况) |
| D、金属-空气电池的可持续应用要求是一方面在工作状态下要有足够的氧气供应,另一方面在非工作状态下能够密封防止金属自腐蚀 |