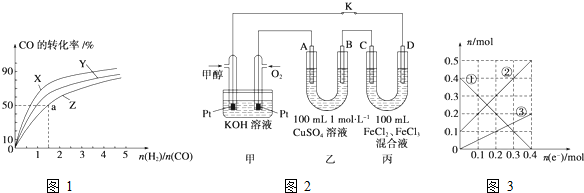
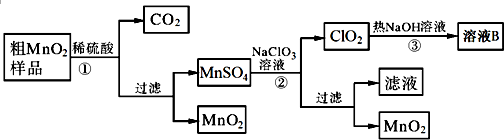
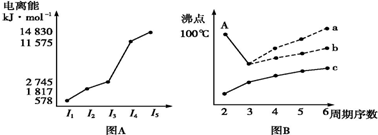
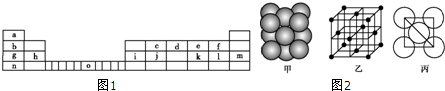
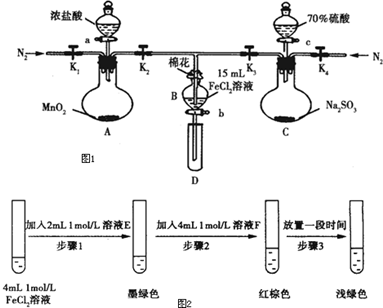
题目内容
药物Z可用于治疗哮喘、系统性红斑狼疮等,可由X(咖啡酸)和Y(1,4-环己二酮单乙二醇缩酮)为原料合成(如图).
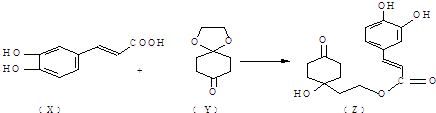
试填空:
(1)X的分子式为 ;该分子中最多共面的碳原子数为 .
(2)Y中是否含有手性碳原子 (填“是”或“否”).
(3)Z能发生 反应.(填序号)
A.取代反应 B.消去反应 C.加成反应
(4)1mol Z在一定条件下与足量H2充分反应,需要消耗H2 mol.

试填空:
(1)X的分子式为
(2)Y中是否含有手性碳原子
(3)Z能发生
A.取代反应 B.消去反应 C.加成反应
(4)1mol Z在一定条件下与足量H2充分反应,需要消耗H2
考点:有机物的结构和性质
专题:有机物的化学性质及推断
分析:(1)由结构简式可知分子式,分子中苯环、C=C均为平面结构,且直接相连;
(2)连4个不同基团的C为手性C原子;
(3)Z中含酚-OH、C=C、-COOC-及醇-OH等;
(4)苯环、C=C及酮中的C=O可与氢气发生加成反应.
(2)连4个不同基团的C为手性C原子;
(3)Z中含酚-OH、C=C、-COOC-及醇-OH等;
(4)苯环、C=C及酮中的C=O可与氢气发生加成反应.
解答:
解:(1)由结构简式可知分子式为C9H8O4,分子中苯环、C=C均为平面结构,且直接相连,则最多9个C原子共面,故答案为:C9H8O4;9;
(2)连4个不同基团的C为手性C原子,分子中的C都不具有手性,故答案为:否;
(3)Z中含酚-OH、-OH-、COOC-可发生取代反应,苯环、C=C及酮中C=O可发生加成反应,醇-OH可发生消去反应,故答案为:ABC;
(4)苯环、C=C及酮中的C=O可与氢气发生加成反应,苯环与氢气以1:3加成,则1mol Z在一定条件下与足量H2充分反应,需要消耗H25mol,故答案为:5.
(2)连4个不同基团的C为手性C原子,分子中的C都不具有手性,故答案为:否;
(3)Z中含酚-OH、-OH-、COOC-可发生取代反应,苯环、C=C及酮中C=O可发生加成反应,醇-OH可发生消去反应,故答案为:ABC;
(4)苯环、C=C及酮中的C=O可与氢气发生加成反应,苯环与氢气以1:3加成,则1mol Z在一定条件下与足量H2充分反应,需要消耗H25mol,故答案为:5.
点评:本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重有机物性质、原子共面、有机反应及手性等知识点的考查,综合性较强,题目难度不大.

练习册系列答案
相关题目
下列有关化学用语表示正确的是( )
| A、二氧化硅的分子式 SiO2 | ||
| B、氧化铁的化学式:FeO | ||
C、次氯酸的电子式 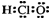 | ||
D、中子数为78的碘原子:
|
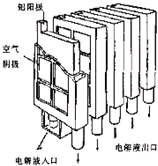 近年来,金属-空气电池的研究和应用取得很大进步这种新型燃料电池具有比能量高、对环境友好、应用场合多等多方面优点.铝-空气电池工作原理如图所示.关于金属-空气电池的说法不正确的是( )
近年来,金属-空气电池的研究和应用取得很大进步这种新型燃料电池具有比能量高、对环境友好、应用场合多等多方面优点.铝-空气电池工作原理如图所示.关于金属-空气电池的说法不正确的是( )| A、铝-空气电池(如图)中,铝作负极,电子通过外电路到正极 |
| B、为帮助电子与空气中的氧气反应,可使用活性炭作正极材料 |
| C、碱性溶液中,负极反应为Al(s)+3OH-(aq)═Al(OH)3(s)+3e-,每消耗2.7g Al(s),需耗氧6.72L(标准状况) |
| D、金属-空气电池的可持续应用要求是一方面在工作状态下要有足够的氧气供应,另一方面在非工作状态下能够密封防止金属自腐蚀 |
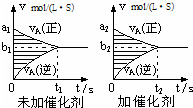 对于可逆反应mA(g)+nB(g)?pC(g)+qD(g),若其它条件都不变,探究催化剂对反应的影响,可得到如下两种v-t图象.下列判断正确的是( )
对于可逆反应mA(g)+nB(g)?pC(g)+qD(g),若其它条件都不变,探究催化剂对反应的影响,可得到如下两种v-t图象.下列判断正确的是( )| A、b1>b2,t1>t2 |
| B、两图中阴影部分面积一定相等 |
| C、A的平衡转化率(Ⅱ)大于(Ⅰ)中A的转化率 |
| D、若m+n<p+q,则压强变化对正反应速率的影响程度比逆反应速率影响程度大 |
2014年“6?5”世界环境日中国主题为“向污染宣战”.下列行为不利于遏制污染的是( )
| A、发展风能和太阳能等清洁能源,减少使用化石燃料 |
| B、扩建小型钢铁厂、水泥厂,提高钢铁、水泥的产量 |
| C、推广机动车用天然气替代汽、柴油的“油改工程” |
| D、研发可降解的聚碳酸酯替代聚乙烯作一次性塑料袋的生产原料 |