题目内容
7.某温度时,N2+3H2?2NH3的平衡常数K=a,则此温度下,NH3?$\frac{3}{2}$H2+$\frac{1}{2}$N2的平衡常数为( )| A. | $\frac{1}{\sqrt{a}}$ | B. | $\sqrt{a}$ | C. | $\frac{1}{2}$a | D. | $\frac{1}{\frac{1}{2}a}$ |
分析 化学平衡常数指一定温度下可逆达到平衡,各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,故相同温度下,同一反应的正、逆反应的平衡常数互为倒数;同一转化关系,化学计量数变为原的n倍,则化学平衡常数为原来的n次方倍,以此来解答.
解答 解:某温度时,N2+3H2?2NH3的平衡常数K=a,
则该温度下,2NH3?N2+3H2的平衡常数K1=$\frac{1}{a}$,
NH3?$\frac{3}{2}$H2+$\frac{1}{2}$N2的平衡常数为$\frac{1}{\sqrt{a}}$,
故选A.
点评 本题考查化学平衡常数及计算,为高频考点,把握化学平衡常数的意义、化学反应的关系为解答的关键,侧重分析与计算能力的考查,注意反应中化学计量数的关系,题目难度不大.

练习册系列答案
相关题目
11.在反应8NH3+3Cl2=6NH4Cl+N2中,若有2molN2生成,则转移电子的物质的量是( )
| A. | 16mol | B. | 6mol | C. | 12mol | D. | 4mol |
12.无色溶液既可能显酸性又可能显碱性,在该溶液中一定能大量共存的离子是( )
| A. | H+ Na+ MnO4- SO42- | B. | Na+ CO32- Mg2+Cl- | ||
| C. | K+Na+ Cl-SO42- | D. | K+ Cl-Ba2+ HCO3- |
9.下列离子方程式表达正确的是( )
| A. | 向Al2(SO4)3溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 向漂白粉稀溶液中通入过量CO2:ClO-+CO2+H2O═HClO+HCO3- | |
| C. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液使SO42-完全沉淀:NH4++Al3++SO42-+Ba2++4OH-═NH3•H2O+Al(OH)3↓+BaSO4↓ | |
| D. | 酸性溶液中KIO3与KI反应:I-+IO3-+6H+═I2+3H2O |
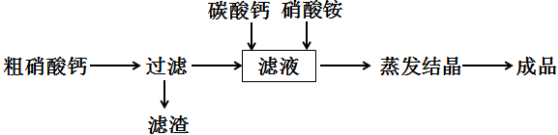
19.碳酸钠的用途很广,可用做冶金、纺织、漂染等工业的基本原料.请根据题意回答下列问题:
Ⅰ.世界最早工业生产碳酸钠的方法是路布兰(N.Leblanc)法.其流程如下:
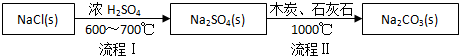
(1)流程I的另一产物是HCl,流程Ⅱ的反应分步进行:a.Na2SO4+4C $\frac{\underline{\;1000℃\;}}{\;}$Na2S+4CO↑;
b.Na2S与石灰石发生复分解反应,总反应方程式可表示为Na2SO4+4C+CaCO3$\frac{\underline{\;1000℃\;}}{\;}$Na2CO3+CaS+4CO↑.
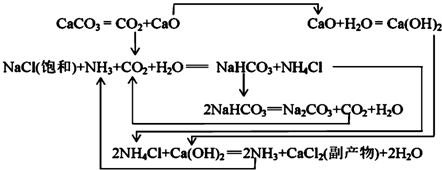
Ⅱ.1862年,比利时人索尔维(Ernest Solvay)用氨碱法生产碳酸钠.反应原理如下:
20℃时一些物质在水中的溶解度/g•(100gH2O)-1
(2)氨碱法生成纯碱的原料是食盐、水、氨气和CO2,可循环利用的物质有CaO、CO2、NH4Cl、NH3.
(3)饱和NaCl溶液通NH3和CO2能生成NaHCO3的原因有:反应体系中NaHCO3溶解度最小、反应消耗水、NaHCO3相对分子质量最大.
Ⅲ.我国化工专家侯德榜研究出联合制碱法,其反应原理和氨碱法类似,但将制氨和制碱联合,提高了原料利用率.
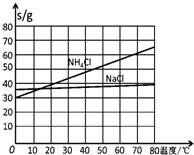
(4)生产中需向分离出NaHCO3后所得的溶液中加入NaCl固体并通入NH3,在0~10℃(填温度范围)下析出NH4Cl.(填化学式)
Ⅰ.世界最早工业生产碳酸钠的方法是路布兰(N.Leblanc)法.其流程如下:
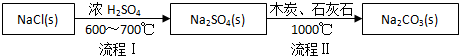
(1)流程I的另一产物是HCl,流程Ⅱ的反应分步进行:a.Na2SO4+4C $\frac{\underline{\;1000℃\;}}{\;}$Na2S+4CO↑;
b.Na2S与石灰石发生复分解反应,总反应方程式可表示为Na2SO4+4C+CaCO3$\frac{\underline{\;1000℃\;}}{\;}$Na2CO3+CaS+4CO↑.
Ⅱ.1862年,比利时人索尔维(Ernest Solvay)用氨碱法生产碳酸钠.反应原理如下:

20℃时一些物质在水中的溶解度/g•(100gH2O)-1
| NaCl | NH4Cl | NaHCO3 | NH4HCO3 | Na2CO3 |
| 35.9 | 37.2 | 9.6 | 21.7 | 21.5 |
(3)饱和NaCl溶液通NH3和CO2能生成NaHCO3的原因有:反应体系中NaHCO3溶解度最小、反应消耗水、NaHCO3相对分子质量最大.
Ⅲ.我国化工专家侯德榜研究出联合制碱法,其反应原理和氨碱法类似,但将制氨和制碱联合,提高了原料利用率.
(4)生产中需向分离出NaHCO3后所得的溶液中加入NaCl固体并通入NH3,在0~10℃(填温度范围)下析出NH4Cl.(填化学式)

 (1)实验室用如图所示装置制备少量乙酸乙酯.
(1)实验室用如图所示装置制备少量乙酸乙酯.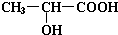 .试回答:
.试回答: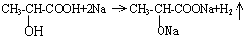 ;
;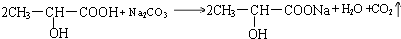 .
.

 为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液,下图是医院给病人输液时使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液的标签.某学生欲在实验室中配制500mL该葡萄糖注射液.
为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液,下图是医院给病人输液时使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液的标签.某学生欲在实验室中配制500mL该葡萄糖注射液.