题目内容
12.硝酸铵钙晶体[5Ca(NO3)2•NH4NO3•10H2O]极易溶于水,是一种绿色的复合肥料.(1)硝酸铵钙晶体的溶液显酸性,原因是NH4++H2O?NH3•H2O+H+(用离子方程式表示).
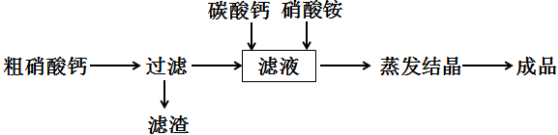
(2)已知磷酸钙是一种难溶物,常温下,其Ksp=2.0×10-33,$\sqrt{2}$≈1.414.工业上生产硝酸铵钙的方法是以硝酸浸取磷矿石得到的粗硝酸钙(含硝酸钙、磷酸钙及硝酸)为原料制备,其生产流程如下:
①在粗硝酸钙浊液中,c(Ca2+)≈0.1mol/L,则其中c(PO43-)约为1.414×10-15mol/L.
②加入适量的碳酸钙后发生反应的离子方程式为CaCO3+2H+═Ca2++CO2↑+H2O.
③硝酸铵是一种易分解的物质,保存和利用时,需控制在较低温度.230~400℃时,它会分解成空气中含量最大的两种气体,其反应的化学方程式为2NH4NO3$\frac{\underline{\;230~400℃\;}}{\;}$2N2↑+O2↑+4H2O.
(3)生产硝酸铵钙工厂的废水中常含有硝酸铵,净化方法有反硝化净化法和电解法.
①NO3-在酸性条件下可转化为N2,该反硝化方法可用半反应(同电极反应式)表示2NO3-+10e-+12H+═6H2O+N2↑.
②目前常用电解法净化,工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过);

Ⅰ.阳极的电极反应为2H2O-4e-═4H++O2↑,
Ⅰ室可回收的产品为硝酸(填名称).
Ⅱ.Ⅲ室可回收到氨气,请结合方程式和文字解 释其原因电解时Ⅲ室氢离子得电子发生还原反应(或2H++2e-=H2),使碱性增强,同时NH4+通过阳离子膜进入III室,发生反应:NH4++OH-=NH3+H2O,生成氨气.
分析 (1)铵根离子水解显酸性;
(2)粗硝酸钙(含硝酸钙、难溶物及硝酸)加水溶解,过滤得含硝酸钙和硝酸的溶液,加入碳酸钙与硝酸铵反应生成硝酸铵钙、水和二氧化碳气体,溶液为硝酸钙和硝酸铵的混合溶液,蒸发结晶得到硝酸铵钙[5Ca(NO3)2•NH4NO3•10H2O]晶体.
①根据Ksp[Ca3(PO4)2]=[c(Ca2+)]3×c(PO43-)计算;
②粗硝酸钙(含硝酸钙、难溶物及硝酸)加水溶解,过滤得含硝酸钙和硝酸的溶液,加入碳酸钙与硝酸反应生成硝酸钙、水和二氧化碳气体;
③硝酸铵分解生成氮气和氧气以及水;
(3)①反硝化是利用某些细菌在酸性条件下将NO3-得到电子发生还原反应生成N2,据此书写;
②根据膜电解法阳极上为水失电子发生的氧化反应;Ⅰ室消耗氢氧根离子使酸性增强,与向阳极移动的硝酸根结合成硝酸;电解时,Ⅲ室为阴极应为氢离子得电子发生还原反应,消耗氢离子使碱性增强,与向阴极移动的铵根离子反应生成氨气,据此分析.
解答 解:(1)铵根离子水解显酸性,则水解离子反应为NH4++H2O?NH3•H2O+H+,
故答案为:NH4++H2O?NH3•H2O+H+;
(2)①Ksp[Ca3(PO4)2]=2×10-33,c(Ca2+)≈0.1mol/L,Ksp[Ca3(PO4)2]=[c(Ca2+)]3×c(PO43-)=2×10-33,(0.1)3×c2(PO43-)=2×10-33,c(PO43-)=1.414×10-15mol/L,
故答案为:1.414×10-15mol/L;
②加入碳酸钙与硝酸反应生成硝酸钙、水和二氧化碳气体,发生反应的离子方程式为CaCO3+2H+═Ca2++CO2↑+H2O,
故答案为:CaCO3+2H+═Ca2++CO2↑+H2O;
③空气中含量最大的两种气体分别是氮气和氧气,依据氧化还原反应原理得出硝酸铵分解方程式为:2NH4NO3$\frac{\underline{\;230~400℃\;}}{\;}$2N2↑+O2↑+4H2O,
故答案为:2NH4NO3$\frac{\underline{\;230~400℃\;}}{\;}$2N2↑+O2↑+4H2O;
(3)①反硝化是利用某些细菌在酸性条件下将NO3-转化为N2,即NO3-得到电子发生还原反应生成N2,反应式为2NO3-+10e-+12H+═6H2O+N2↑,
故答案为:2NO3-+10e-+12H+═6H2O+N2↑;
②膜电解法阳极上为水失电子发生的氧化反应,反应式为2H2O-4e-═4H++O2↑,则Ⅰ室阳极消耗氢氧根离子使酸性增强,与向阳极移动的硝酸根结合成硝酸,所以Ⅰ室可回收的产品为硝酸,电解时,Ⅲ室为阴极应为氢离子得电子发生还原反应(或2H++2e-=H2),则消耗氢离子使碱性增强,与向阴极移动的铵根离子反应生成氨气,发生反应:NH4++OH-=NH3+H2O,所以Ⅲ室可回收到氨气,
故答案为:2H2O-4e-═4H++O2↑;硝酸;电解时Ⅲ室氢离子得电子发生还原反应(或2H++2e-=H2),使碱性增强,同时NH4+通过阳离子膜进入III 室,发生反应:NH4++OH-=NH3+H2O,生成氨气.
点评 本题主要考查了工业生产硝酸铵钙的原理及废水的处理,意在考查考生阅读新信息,处理新情况的能力,电解装置的分析及其电极反应式的书写是易错点,题目难度中等.

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案| A. | 合成氨工业上增大压强以提高反应物的转化率 | |
| B. | 黄绿色的氯水光照后颜色变浅 | |
| C. | 由H2、I2蒸气、HI组成的平衡体系加压后颜色变深 | |
| D. | 在含有Fe(SCN)2+的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去 |
| A. | 在0.1 mol•L-1Na2S溶液中:2c(Na+)>c(S2-)>c(HS-)>c(OH-) | |
| B. | 一定量的(NH4)2SO4与NH3•H2O混合所得的酸性溶液中:c(NH4+)<2c(SO42-) | |
| C. | 将0.1 mol•L-1盐酸与0.1 mol•L-1K2CO3溶液等体积混合:c(K+)>c(Cl-)>c(OH-)>c(HCO3-)>c(H+) | |
| D. | 将0.1 mol•L-1Na2CO3溶液和0.1 mol•L-1NaHCO3溶液等体积混合:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| A. | $\frac{1}{\sqrt{a}}$ | B. | $\sqrt{a}$ | C. | $\frac{1}{2}$a | D. | $\frac{1}{\frac{1}{2}a}$ |
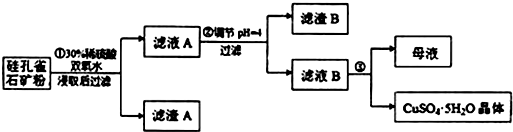
请回答下列问题:
(1)完成步骤①中稀硫酸与CuSiO3•2H2O发生反应的化学方程式
CuSiO3•2H2O+H2SO4═CuSO4+H4SiO4+H2O;
用离子方程式表示双氧水的作用2Fe2++H2O2+2H+═2Fe3++2H2O.
(2)步骤②调节溶液pH选用的最佳试剂是B
A.Fe2O3 B.CuO C.Al2O3 D.NH3•H2O
(3)有关氢氧化物开始沉淀和完全沉淀的pH如表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 完全沉淀的pH | 5.2 | 3.7 | 9.7 | 6.7 |
(4)滤液B通过蒸发浓缩(设体积浓缩为原来的一半)、冷却结晶可以得到CuSO4•5H2O晶体.某同学认为上述操作会拌有硫酸铝晶体的析出.请你结合相关数据对该同学的观点予以评价(已知常温下,Al2(SO4)3饱和溶液中c(Al3+)=2.25mol•L-1,Ksp[Al(OH)3]=3.2×10-34)该同学的观点是错误的;通过计算可知,滤液B中,c(Al3+)=3.2×10-4mol/L,浓缩后c(Al3+)=6.4×10-4mol/L<<2.25mol/L,所以不会有硫酸铝晶体析出.
| 选项 | 容量瓶的容积 | 固体质量 | 实验操作 |
| A | 480mL | 硫酸铜:7.7g | 加入500mL水 |
| B | 480mL | 胆矾:12.0g | 配成500mL溶液 |
| C | 500mL | 硫酸铜:8.0g | 加入500mL水 |
| D | 500mL | 胆矾:12.5g | 配成500mL溶液 |
| A. | A | B. | B | C. | C | D. | D |