题目内容
氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成都需要用氯气.
I.工业上通常采用电解法制氯气:观察图1,回答:
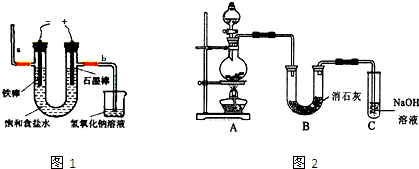
(1)电解反应的化学方程式为 .
(2)若饱和食盐水中通电后,b侧产生的气体检验方法是 .
Ⅱ.某学生设计如图2所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),回答下列问题:
(1)在A装置中用固体二氧化锰与浓盐酸,在加热条件下制取氯气,写出反应的化学方程式并用双线桥法表示出反应中电子转移的方向和数目 ;若在标准状态下收集到22.4升的氯气,则被氧化的HCl的物质的量是 .
(2)漂白粉将在U形管中产生,其化学方程式是 .
(3)C装置的作用是 .
(4)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应.①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是 .
②试判断另一个副反应(用化学方程式表示) .为避免此副反应的发生,可将装置做何改进 .
I.工业上通常采用电解法制氯气:观察图1,回答:

(1)电解反应的化学方程式为
(2)若饱和食盐水中通电后,b侧产生的气体检验方法是
Ⅱ.某学生设计如图2所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),回答下列问题:
(1)在A装置中用固体二氧化锰与浓盐酸,在加热条件下制取氯气,写出反应的化学方程式并用双线桥法表示出反应中电子转移的方向和数目
(2)漂白粉将在U形管中产生,其化学方程式是
(3)C装置的作用是
(4)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应.①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是
②试判断另一个副反应(用化学方程式表示)
考点:氯气的实验室制法,氯碱工业
专题:电化学专题,卤族元素
分析:(1)电解饱和食盐水可以得到氢氧化钠、氯气和氢气;
(2)b侧产生的气体是氯气,氯气与碘化钾反应生成单质碘,单质碘遇到淀粉变蓝;
Ⅱ.(1)反应MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O中,Mn元素化合价由+4价降低到+2价,Cl元素化合价由-1价升高,根据化合价的变化可知电子的转移方向和数目;生成1mol氯气,消耗4mol氯化氢,2mol氯化氢显酸性,2mol氯化氢显还原性被氧化;
(2)氯气与氢氧化钙反应生成氯化钙、次氯酸钙和水;
(3)氯气有毒,不能直接排放到空气中,需要进行尾气吸收;
(4)①依据信息可知温度较高时氯气与消石灰反应生成Ca(ClO3)2,为为避免此副反应的发生应降低温度;
②挥发出的氯化氢能够与氢氧化钙发生酸碱中和反应;要避免此反应的发生应该除去氯气中的氯化氢.
(2)b侧产生的气体是氯气,氯气与碘化钾反应生成单质碘,单质碘遇到淀粉变蓝;
Ⅱ.(1)反应MnO2+4HCl(浓)
| ||
(2)氯气与氢氧化钙反应生成氯化钙、次氯酸钙和水;
(3)氯气有毒,不能直接排放到空气中,需要进行尾气吸收;
(4)①依据信息可知温度较高时氯气与消石灰反应生成Ca(ClO3)2,为为避免此副反应的发生应降低温度;
②挥发出的氯化氢能够与氢氧化钙发生酸碱中和反应;要避免此反应的发生应该除去氯气中的氯化氢.
解答:
解:Ⅰ.(1)电解饱和食盐水的化学方程式是:2NaCl+2H2O
2NaOH+H2↑+Cl2↑,
故答案为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑;
(2)b侧产生的气体是氯气,能使湿润的淀粉碘化钾试纸变蓝,
故答案为:移走烧杯,将湿润的淀粉碘化钾试纸放在b导气管口处,若试纸变蓝,则说明产生的气体为Cl2;
Ⅱ(1)反应MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O中,Mn元素化合价由+4价降低到+2价,Cl元素化合价由-1价升高,该反应的电子转移方向和数目可表示为 ;氯化氢在反应中既表现酸性又表现还原性,4mol氯化氢参加反应,表现为酸性的占
;氯化氢在反应中既表现酸性又表现还原性,4mol氯化氢参加反应,表现为酸性的占
,若在标准状态下收集到22.4升的氯气,物质的量为:
=1mol,依据方程式可知参加反应的盐酸有4mol,被氧化的氯化氢为2mol,
故答案为: ;2mol;
;2mol;
(2)氯气和氢氧化钙反应的化学方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(3)氯气有毒,不能直接排放到空气中,
故答案为:吸收未反应完的氯气,防止污染空气;
(4)①依据信息可知温度较高时氯气与消石灰反应生成Ca(ClO3)2,为为避免此副反应的发生应该冷却B装置;
故答案为:冷却B装置;
②挥发出的氯化氢能够与氢氧化钙发生酸碱中和反应,方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;要避免此反应的发生应该除去氯气中的氯化氢,可以在A与B之间连接一个装有饱和氯化钠溶液的洗气瓶,
故答案为:2HCl+Ca(OH)2=CaCl2+2H2O;在A与B之间连接一个装有饱和氯化钠溶液的洗气瓶.
| ||
故答案为:2NaCl+2H2O
| ||
(2)b侧产生的气体是氯气,能使湿润的淀粉碘化钾试纸变蓝,
故答案为:移走烧杯,将湿润的淀粉碘化钾试纸放在b导气管口处,若试纸变蓝,则说明产生的气体为Cl2;
Ⅱ(1)反应MnO2+4HCl(浓)
| ||
 ;氯化氢在反应中既表现酸性又表现还原性,4mol氯化氢参加反应,表现为酸性的占
;氯化氢在反应中既表现酸性又表现还原性,4mol氯化氢参加反应,表现为酸性的占| 1 |
| 2 |
| 22.4L |
| 22.4L/mol |
故答案为:
 ;2mol;
;2mol;(2)氯气和氢氧化钙反应的化学方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(3)氯气有毒,不能直接排放到空气中,
故答案为:吸收未反应完的氯气,防止污染空气;
(4)①依据信息可知温度较高时氯气与消石灰反应生成Ca(ClO3)2,为为避免此副反应的发生应该冷却B装置;
故答案为:冷却B装置;
②挥发出的氯化氢能够与氢氧化钙发生酸碱中和反应,方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;要避免此反应的发生应该除去氯气中的氯化氢,可以在A与B之间连接一个装有饱和氯化钠溶液的洗气瓶,
故答案为:2HCl+Ca(OH)2=CaCl2+2H2O;在A与B之间连接一个装有饱和氯化钠溶液的洗气瓶.
点评:本题考查了氯气的实验室制法和氯气的性质,氧化还原反应的规律,题目难度中等,解题关键在于明确实验室制备氯气的原理和氯气的性质.

练习册系列答案
相关题目
常温时,向纯水中加入氢氧化钠,使溶液的pH为12,则由氢氧化钠电离出的OH-浓度与水电离出的OH-浓度之比为( )
| A、1:1 |
| B、1010:1 |
| C、109:1 |
| D、108:1 |
 如图是实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制480mL 1mol/L的稀硫酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平.请回答下列问题:
如图是实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制480mL 1mol/L的稀硫酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平.请回答下列问题: