题目内容
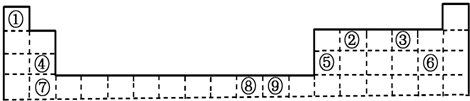
上表为周期表的一部分,其中的编号代表所对应的元素.请回答下列问题:
(1)⑨号元素的基态原子的价电子排布式是
(2)①号与③号元素形成的含有18电子的物质为
(3)①、②两种元素能形成多种平面形分子,其中有一种相对分子质量最小,有关该分子的说法中正确的是
a.该分子属于含有极性键的非极性分子 b.该分子含有4个σ键和1个π键
c.该分子中的②原子采取sp2杂化 d.该物质易溶于水,并能和水反应得到酒精
(4)某元素的价电子排布式为nsnnpn+1,该元素可与元素①形成含有10个电子的分子X,将过量的X通入盛有硫酸铜溶液的试管里,产生的现象为
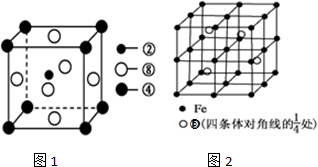
(5)若⑤元素与Fe元素形成某种晶体如图2所示.若晶胞的边长为a nm,则合金的密度为
考点:位置结构性质的相互关系应用,晶胞的计算
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:由元素在周期表中的位置可知,①为H、②为C、③为O、④为Mg、⑤为Al、⑥为Cl、⑦为Ca、⑧为Ni、⑨为Cu,
(1)⑨为Cu,根据核外电子排布规律书写价电子排布式;第四周期中核外未成对电子数最多,外围电子排布为3d54s1;②为C元素,原子核外有6个电子,根据核外电子排布规律画出其电子排布图;
(2)①号与③号元素形成的含有18电子的物质为H2O2;②号与③号元素形成的,能造成温室效应的物质为CO2;根据均摊法计算晶胞中各原子数目,进而确定化学式;根据氢键分析甲醇在常温下为液态;
(3)①、②两种元素能形成多种平面形分子,其中有一种相对分子质量最小,该分子为C2H2;
(4)某元素的价电子排布式为nsnnpn+1,由于s能级只能容纳2个电子,故为N元素,该元素可与元素①形成含有10个电子的分子X为NH3,将过量的NH3通入盛有硫酸铜溶液的试管里,先生成氢氧化铜蓝色沉淀,后氢氧化铜溶解,生成四氨合铜络离子,溶液呈深蓝色;
(5)晶胞中含有4个Al原子,根据均摊法计算Fe原子数目,进而计算晶胞质量,计算晶胞体积,根据ρ=
晶胞密度.
(1)⑨为Cu,根据核外电子排布规律书写价电子排布式;第四周期中核外未成对电子数最多,外围电子排布为3d54s1;②为C元素,原子核外有6个电子,根据核外电子排布规律画出其电子排布图;
(2)①号与③号元素形成的含有18电子的物质为H2O2;②号与③号元素形成的,能造成温室效应的物质为CO2;根据均摊法计算晶胞中各原子数目,进而确定化学式;根据氢键分析甲醇在常温下为液态;
(3)①、②两种元素能形成多种平面形分子,其中有一种相对分子质量最小,该分子为C2H2;
(4)某元素的价电子排布式为nsnnpn+1,由于s能级只能容纳2个电子,故为N元素,该元素可与元素①形成含有10个电子的分子X为NH3,将过量的NH3通入盛有硫酸铜溶液的试管里,先生成氢氧化铜蓝色沉淀,后氢氧化铜溶解,生成四氨合铜络离子,溶液呈深蓝色;
(5)晶胞中含有4个Al原子,根据均摊法计算Fe原子数目,进而计算晶胞质量,计算晶胞体积,根据ρ=
| m |
| V |
解答:
解:由元素在周期表中的位置可知,①为H、②为C、③为O、④为Mg、⑤为Al、⑥为Cl、⑦为Ca、⑧为Ni、⑨为Cu,
(1)⑨为Cu,核外电子总数为29,其价电子排布式为:3d104s1;第四周期中核外未成对电子数最多,外围电子排布为3d54s1,是Cr元素;
②为C元素,原子核外有6个电子,其核外电子排布图为 ,
,
故答案为:3d104s1;Cr; ;
;
(2)①号与③号元素形成的含有18电子的物质为H2O2,名称为过氧化氢;
②号与③号元素形成的,能造成温室效应的物质为CO2,为直线型结构;
图一所示晶胞中,C原子数目=1,原子数目=6×
=3,Mg原子数目=8×
=1,该晶体化学式为:Ni3MgC;
由于甲醇分子间存在氢键,而丙烯分子间只有范德华力,常温条件下丙烯是气态,而相对分子质量比丙烯小的甲醇,常温条件下却呈液态,
故答案为:过氧化氢;直线型;Ni3MgC;甲醇分子间存在氢键,而丙烯分子间只有范德华力;
(3)①、②两种元素能形成多种平面形分子,其中有一种相对分子质量最小,该分子为C2H2,
a.该分子为直线型对称结构,分子中正负电荷重心重合,属于非极性分子,且C-H键为极性键,属于含有极性键的非极性分子,故a正确;
b.该分子结构式为H-C≡C-H,含有3个σ键和2个π键,故b错误;
c.该分子中的C原子呈2个个σ键、没有孤电子对,采取sp2杂化,故c正确;
d.该物质不溶于水,能和水反应得到乙醛,故d错误,
故答案为:ac;
(4)某元素的价电子排布式为nsnnpn+1,由于s能级只能容纳2个电子,故为N元素,该元素可与元素①形成含有10个电子的分子X为NH3,将过量的NH3通入盛有硫酸铜溶液的试管里,先生成氢氧化铜蓝色沉淀,后氢氧化铜溶解,生成四氨合铜络离子,溶液呈深蓝色,
故答案为:先产生蓝色沉淀,后沉淀消失,溶液变成深蓝色;
(5)晶胞中有4个Al原子,晶胞中Fe原子数目=1+8×
+6×
+12×
=8,晶胞的质量=4×
g,晶胞的边长为a nm,则晶胞体积=(a×10-7 cm)3=a3×10-21 cm3,故晶胞的密度=
=
g/cm3,
故答案为:
.
(1)⑨为Cu,核外电子总数为29,其价电子排布式为:3d104s1;第四周期中核外未成对电子数最多,外围电子排布为3d54s1,是Cr元素;
②为C元素,原子核外有6个电子,其核外电子排布图为
 ,
,故答案为:3d104s1;Cr;
 ;
;(2)①号与③号元素形成的含有18电子的物质为H2O2,名称为过氧化氢;
②号与③号元素形成的,能造成温室效应的物质为CO2,为直线型结构;
图一所示晶胞中,C原子数目=1,原子数目=6×
| 1 |
| 2 |
| 1 |
| 8 |
由于甲醇分子间存在氢键,而丙烯分子间只有范德华力,常温条件下丙烯是气态,而相对分子质量比丙烯小的甲醇,常温条件下却呈液态,
故答案为:过氧化氢;直线型;Ni3MgC;甲醇分子间存在氢键,而丙烯分子间只有范德华力;
(3)①、②两种元素能形成多种平面形分子,其中有一种相对分子质量最小,该分子为C2H2,
a.该分子为直线型对称结构,分子中正负电荷重心重合,属于非极性分子,且C-H键为极性键,属于含有极性键的非极性分子,故a正确;
b.该分子结构式为H-C≡C-H,含有3个σ键和2个π键,故b错误;
c.该分子中的C原子呈2个个σ键、没有孤电子对,采取sp2杂化,故c正确;
d.该物质不溶于水,能和水反应得到乙醛,故d错误,
故答案为:ac;
(4)某元素的价电子排布式为nsnnpn+1,由于s能级只能容纳2个电子,故为N元素,该元素可与元素①形成含有10个电子的分子X为NH3,将过量的NH3通入盛有硫酸铜溶液的试管里,先生成氢氧化铜蓝色沉淀,后氢氧化铜溶解,生成四氨合铜络离子,溶液呈深蓝色,
故答案为:先产生蓝色沉淀,后沉淀消失,溶液变成深蓝色;
(5)晶胞中有4个Al原子,晶胞中Fe原子数目=1+8×
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |
| 139 |
| NA |
4×
| ||
| a3×10-21cm3 |
| 5.56×1023 |
| a3NA |
故答案为:
| 5.56×1023 |
| a3NA |
点评:本题是对物质结构与性质的考查,涉及结构性质位置关系、核外电子排布、分子结构与性质、氢键、杂化轨道、配合物、晶胞计算等,题目比较综合,需要学生晶胞扎实的基础,难度中等,注意利用均摊法进行晶胞的有关计算.

练习册系列答案
相关题目
使用哪组试剂,可鉴别在不同试剂瓶内的1-己烯、甲苯和丙醛( )
| A、KMnO4酸性溶液和溴的CCl4溶液 |
| B、银氨溶液和溴的CCl4溶液 |
| C、FeCl3溶液和银氨溶液 |
| D、银氨溶液和KMnO4酸性溶液 |
下列表达方式中错误的是( )
A、次氯酸电子式: | ||
B、S2-的结构示意图: | ||
C、O-18的原子符号:
| ||
| D、CO2分子的结构式:O=C=O |
 如图是铊化钠的晶胞结构:
如图是铊化钠的晶胞结构:

 和
和 ⑥
⑥ 和
和