题目内容
镁在高温下与O2、N2或CO2均可以发生反应,试解决下列问题.
(1)工业通常采用电解熔融氯化镁冶炼金属镁,不以氧化镁为原料的理由是 .
(2)将燃着的镁条伸入盛满CO2的集气瓶中,镁条剧烈燃烧,发出耀眼的白光,瓶内壁上有黑色物质生成,化学方程式为 .
(3)由金红石(TiO2)制取单质钛(Ti),涉及到的反应步骤为
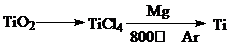
金属镁的作用为 ,在Ar气氛中的进行的理由是 .
(4)现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2).已知:
Mg+H2
MgO+H2↑ Mg3N2+6H2O═3Mg(OH)2+2NH3↑
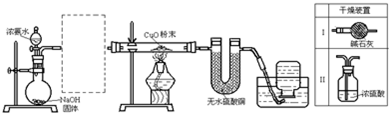
可供选择的装置和药品如图所示.
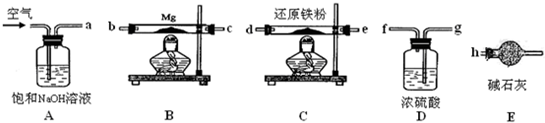
①导管口间的连接次序是:a→ → → →h
②通气后,应先点燃 (填“B”或“C”)装置的酒精灯,装置A的作用是 ,装置E的作用是 .
③请设计一个简单的小实验验证产物是氮化镁 .
(1)工业通常采用电解熔融氯化镁冶炼金属镁,不以氧化镁为原料的理由是
(2)将燃着的镁条伸入盛满CO2的集气瓶中,镁条剧烈燃烧,发出耀眼的白光,瓶内壁上有黑色物质生成,化学方程式为
(3)由金红石(TiO2)制取单质钛(Ti),涉及到的反应步骤为
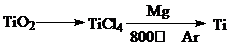
金属镁的作用为
(4)现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2).已知:
Mg+H2
| ||
可供选择的装置和药品如图所示.

①导管口间的连接次序是:a→
②通气后,应先点燃
③请设计一个简单的小实验验证产物是氮化镁
考点:镁的化学性质,制备实验方案的设计
专题:实验题,几种重要的金属及其化合物
分析:(1)MgO熔点很高,能耗太大,不经济;
(2)镁与二氧化碳反应生成氧化镁和碳;
(3)四氯化钛中钛元素化合价为+4价与镁反应后化合价为0价,被还原,发生还原反应,需要加还原剂;空气中的O2(CO2或N2)都能够与金属镁反应,为防止发生反应,可以氩气作保护气;
(4)①空气中含有二氧化碳和氧气,分别通过A除去二氧化碳,通过D除去水蒸气,通过C除去氧气,在B中氮气和镁反应生成氮化镁,注意防止空气中防止空气中的水蒸气进入与Mg3N2反应,所以B后面接E;
②通气后,先排除空气中的杂质,所以应该先点燃C;通过A除去二氧化碳;空气中的水蒸气与Mg3N2反应;
③氮化镁与水反应生成氢氧化镁和氨气,检验氨气的存在即可证明有氮化镁.
(2)镁与二氧化碳反应生成氧化镁和碳;
(3)四氯化钛中钛元素化合价为+4价与镁反应后化合价为0价,被还原,发生还原反应,需要加还原剂;空气中的O2(CO2或N2)都能够与金属镁反应,为防止发生反应,可以氩气作保护气;
(4)①空气中含有二氧化碳和氧气,分别通过A除去二氧化碳,通过D除去水蒸气,通过C除去氧气,在B中氮气和镁反应生成氮化镁,注意防止空气中防止空气中的水蒸气进入与Mg3N2反应,所以B后面接E;
②通气后,先排除空气中的杂质,所以应该先点燃C;通过A除去二氧化碳;空气中的水蒸气与Mg3N2反应;
③氮化镁与水反应生成氢氧化镁和氨气,检验氨气的存在即可证明有氮化镁.
解答:
解:(1)MgO熔点很高,用电解熔融氯化镁冶炼金属镁,能耗太大,不经济,
故答案为:MgO熔点很高,能耗太大;
(2)镁与二氧化碳反应生成氧化镁和碳反应的化学方程式为:2Mg+CO2
2MgO+C,
故答案为:2Mg+CO2
2MgO+C;
(3)四氯化钛中钛元素化合价为+4价降低为0价被还原,发生还原反应,需要加入镁作还原剂,空气中的O2(CO2或N2)都能够与金属镁反应,为防止发生反应,可以氩气作保护气;
故答案为:作还原剂;氩气作保护气,防止高温下Mg(或Ti)在空气中的O2(CO2或N2)作用
(4)①分别通过A除去二氧化碳,通过D除去水蒸气,通过C除去氧气,在B中氮气和镁反应生成氮化镁,注意防止空气中防止空气中的水蒸气进入与Mg3N2反应,所以B后面接E;所以正确的连接顺序为:①a→( g )( f )→( d )( e )→( b )( c )→h;
故答案为:a→( g )( f )→( d )( e )→( b )( c )→h;
②通气后,先排除空气中的杂质,所以应该先点燃C;通过A除去二氧化碳;空气中的水蒸气与Mg3N2反应;
故答案为:C; 除去空气中的CO2; 防止空气中的水蒸气进入与Mg3N2反应;
③氮化镁与水反应生成氢氧化镁和氨气,检验氨气的存在即可证明有氮化镁,
故答案为:取少量产物置于试管中,加入适量水,将润湿的红色石蕊试纸置于试管口,如果能够看到润湿的红色石蕊试纸变蓝,则说明产物是氮化镁.
故答案为:MgO熔点很高,能耗太大;
(2)镁与二氧化碳反应生成氧化镁和碳反应的化学方程式为:2Mg+CO2
| ||
故答案为:2Mg+CO2
| ||
(3)四氯化钛中钛元素化合价为+4价降低为0价被还原,发生还原反应,需要加入镁作还原剂,空气中的O2(CO2或N2)都能够与金属镁反应,为防止发生反应,可以氩气作保护气;
故答案为:作还原剂;氩气作保护气,防止高温下Mg(或Ti)在空气中的O2(CO2或N2)作用
(4)①分别通过A除去二氧化碳,通过D除去水蒸气,通过C除去氧气,在B中氮气和镁反应生成氮化镁,注意防止空气中防止空气中的水蒸气进入与Mg3N2反应,所以B后面接E;所以正确的连接顺序为:①a→( g )( f )→( d )( e )→( b )( c )→h;
故答案为:a→( g )( f )→( d )( e )→( b )( c )→h;
②通气后,先排除空气中的杂质,所以应该先点燃C;通过A除去二氧化碳;空气中的水蒸气与Mg3N2反应;
故答案为:C; 除去空气中的CO2; 防止空气中的水蒸气进入与Mg3N2反应;
③氮化镁与水反应生成氢氧化镁和氨气,检验氨气的存在即可证明有氮化镁,
故答案为:取少量产物置于试管中,加入适量水,将润湿的红色石蕊试纸置于试管口,如果能够看到润湿的红色石蕊试纸变蓝,则说明产物是氮化镁.
点评:本题为综合题,主要考查了金属镁的性质,题目难度中等,氮化镁制备的实验分析是难点,注意把握反应的实质和各个仪器的用途是解题的关键.

练习册系列答案
相关题目
下列关于有机物的说法正确的是( )
| A、乙烯和苯都能使溴水褪色,褪色的原因相同 |
| B、淀粉、蛋白质完全水解的产物互为同分异构体 |
| C、乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去 |
| D、石油裂解和油脂皂化都有高分子生成小分子的过程 |



 Ⅰ:下列各项分别与哪个影响化学反应速率因素的关系最为密切?
Ⅰ:下列各项分别与哪个影响化学反应速率因素的关系最为密切?