题目内容
16.将等物质的量的Na2CO3、NaHCO3组成的混合物溶于水,配成1L溶液,取出50ml溶液,然后用0.05mol/L盐酸与它反应,得到图象如下(已知:1mol=1000mmol)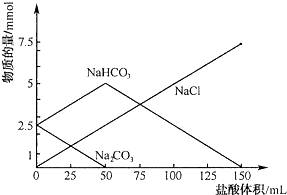
(1)盐酸加到25mL时溶液中发生反应的化学方程式Na2CO3+HCl=NaCl+NaHCO3.
(2)原混合物中Na2CO3物质的量为0.05mol
(3)盐酸加到150mL时,放出标准状况下气体112mL.
分析 (1)由图可知当盐酸加到25mL时,碳酸钠部分反应,反应的化学方程式为:Na2CO3+HCl=NaCl+NaHCO3;
(2)由图可知50ml溶液中碳酸钠完全转化为:碳酸氢钠和氯化钠,消耗盐酸的体积为:50ml,根据反应方程式计算碳酸钠的物质的量;
(3)由图50ml~150ml,发生反应为:NaHCO3+HCl=NaCl+H2O+CO2↑,由此分析解答.
解答 解:(1)由图可知当盐酸加到25mL时,碳酸钠部分反应,反应的化学方程式为:Na2CO3+HCl=NaCl+NaHCO3,故答案为:Na2CO3+HCl=NaCl+NaHCO3;
(2)由图可知50ml溶液中碳酸钠完全转化为:碳酸氢钠和氯化钠,消耗盐酸的体积为:50ml,由Na2CO3+HCl=NaCl+NaHCO3 可知:n(Na2CO3)=n(HCl)=0.05mol/L×0.05L=0.0025mol,所以1L溶液中碳酸钠的物质的量为:0.0025mol×$\frac{1000}{50}$=0.05mol,故答案为:0.05;
(3)由图50ml~150ml,发生反应为:NaHCO3+HCl=NaCl+H2O+CO2↑,可知n(CO2)=n(HCl)=100×10-3×0.05×22.4=0.112L=112mL,故答案为:112.
点评 本题考查混合物反应的计算,题目难度中等,明确反应的先后顺序及图象中每段图象对应的化学反应是解答本题的关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
4.NA表示阿伏加德罗常数的值,下列有关说法正确的是( )
| A. | 12g 金刚石中含有的六元碳环数为NA | |
| B. | 1L1mol/L 的甲醇水溶液中含有氢原子总数为4NA | |
| C. | 12g 石墨和 C60的混合物中质子总数为6NA | |
| D. | 反应 KIO3+6HI=KI+3H2O+3I2中,生成1molI2转移电子的总数为2NA |
11.下列有关电解质溶液的叙述正确的是( )
| A. | 常温下,将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7,则滤液中: c(H+)+c(NH4+)═c(OH-)+c(HCO3-)+2c(CO32-) | |
| B. | 40℃时,在氨水体系中不断通入CO2,随着CO2的通入,$\frac{c(OHˉ)}{c(NH3•H2O)}$不断增大 | |
| C. | 室温下,将0.05mol Na2CO3固体溶于水配成100mL溶液,向溶液中加入0.05molCaO,所得溶液中$\frac{c(O{H}^{-})}{c(HC{O}_{3}^{-})}$增大 | |
| D. | 为确定H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
8.下列物质按纯净物、混合物、电解质、非电解质的顺序组合的一组为( )
| A. | 纯盐酸、空气、硫酸、干冰 | B. | 蒸馏水、氨水、氯化钠、二氧化硫 | ||
| C. | 胆矾、盐酸、铁、碳酸钙 | D. | 生石灰、漂白粉、氯化铜、碳酸钠 |
5.短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中,常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液.下列说法正确的是( )
| A. | 元素Y的最高正化合价为+6 | B. | 离子半径的大小顺序为W>Q>Z>X>Y | ||
| C. | 工业上用电解法冶炼Z单质 | D. | 元素Q的含氧酸的酸性一定比W的强 |
6.下列物质均属于纯净物的一组是( )
| A. | 冰水混合物、TNT、溴苯、胆矾 | |
| B. | 爆鸣气、铝热剂、普通玻璃、漂白粉 | |
| C. | 二甲苯、C5H10、花生油、福尔马林 | |
| D. | 水玻璃、密封保存的NO2气体、甲醛、氯化银 |


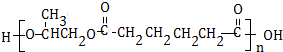 .
.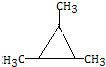 .
.