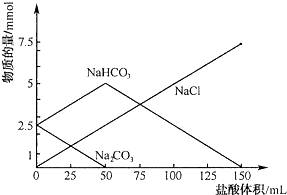
题目内容
11.下列有关电解质溶液的叙述正确的是( )| A. | 常温下,将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7,则滤液中: c(H+)+c(NH4+)═c(OH-)+c(HCO3-)+2c(CO32-) | |
| B. | 40℃时,在氨水体系中不断通入CO2,随着CO2的通入,$\frac{c(OHˉ)}{c(NH3•H2O)}$不断增大 | |
| C. | 室温下,将0.05mol Na2CO3固体溶于水配成100mL溶液,向溶液中加入0.05molCaO,所得溶液中$\frac{c(O{H}^{-})}{c(HC{O}_{3}^{-})}$增大 | |
| D. | 为确定H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
分析 A.常温下,将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7,溶液中为氯化铵和碳酸氢钠的饱和溶液,结合溶液中电荷守恒分析;
B.根据Kb=$\frac{c(N{{H}_{4}}^{+})c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$分析;
C.氧化钙和水反应生成氢氧化钙,氢氧化钙和碳酸钠反应生成碳酸钙和氢氧化钠,溶液中氢氧根浓度增大,碳酸氢根离子浓度减小;
D.若NaHA溶液的pH<7,H2A也可能是弱酸;
解答 解:A.溶液中存在电荷守恒:c(Na+)+c(H+)+c(NH4+)=c(OH-)+c(HCO3-)+2c(CO32-)+c(Cl-),故A错误;
B.已知Kb=$\frac{c(N{{H}_{4}}^{+})c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$,温度一定时,Kb为常数,不随浓度的变化而变化,随着CO2的通入,c(NH4+)逐渐增大,则$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断减小,故B错误;
C.氧化钙和水反应生成氢氧化钙,氢氧化钙和碳酸钠反应:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH,溶液中氢氧根浓度增大,消耗碳酸根离子,溶液中碳酸氢根离子浓度减小,溶液中$\frac{c(O{H}^{-})}{c(HC{{O}_{3}}^{-})}$增大,故C正确;
D.若NaHA溶液的pH<7,H2A也可能是弱酸,如亚硫酸氢钠溶液呈酸性,但亚硫酸是弱酸,故D错误;
故选C.
点评 本题考查盐类水解、弱电解质的电离等知识点,明确弱电解质电离及盐类水解特点即可解答,注意溶液中电荷守恒、电离平衡影响因素等知识点,掌握基础是解题关键,题目难度中等.

 某蓄电池如图所示,以多硫化钠(Na2Sx)、溴化钠(NaBr)水溶液为电解液及电池电化学反应活性物质,电池充放电所发生的反应为2NaBr+(x-1)Na2Sx$?_{充电}^{放电}$Br2+xNa2S(x-1),x为2~4.下列有关判断错误的是( )
某蓄电池如图所示,以多硫化钠(Na2Sx)、溴化钠(NaBr)水溶液为电解液及电池电化学反应活性物质,电池充放电所发生的反应为2NaBr+(x-1)Na2Sx$?_{充电}^{放电}$Br2+xNa2S(x-1),x为2~4.下列有关判断错误的是( )| A. | 电池放电时M为负极 | |
| B. | 电池放电时,N极区c(Na+)不断增加 | |
| C. | 电池充电时,A应接外电源的负极 | |
| D. | 电池充电时N极的电极反应式为(x-1)Sx2-+2e-═xS(x-1)2- |
| A. | 常温常压下,46g有机物C2H6O中含有极性键的数目一定为7NA | |
| B. | 25℃时,1L pH=12的Ba(OH)2溶液中含有的OH-数目为0.02NA | |
| C. | 4.6g Na与足量O2反应后的产物中含离子数目为0.3NA | |
| D. | 标准状况下,2.24L Cl2通入足量H2O反应转移的电子数为0.1NA |
| A. | 由W与X组成的化合物的沸点总高于由W与Y组成的化合物的沸点 | |
| B. | 以上四种元素的原子半径大小为W<X<Y<Z | |
| C. | W、X、Y、Z原子的核外最外层电子数的总和为23 | |
| D. | W 与 Y 可形成离子化合物 |
| A. |  电解水 | B. |  太阳能热水器 | ||
| C. |  水力发电 | D. |  干电池 |
| A. | 元素周期表中位于金属与非金属分界线附近的元素属于过渡元素 | |
| B. | 水是一种非常稳定的化合物,这是由于氢键所致 | |
| C. | 由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S | |
| D. | 离子化合物中可能含有共价键 |
| A. | 纯碱、烧碱均属碱 | B. | SiO2、SO2均属酸性氧化物 | ||
| C. | 凡能电离出H+的化合物均属酸 | D. | 盐类物质一定含有金属离子 |
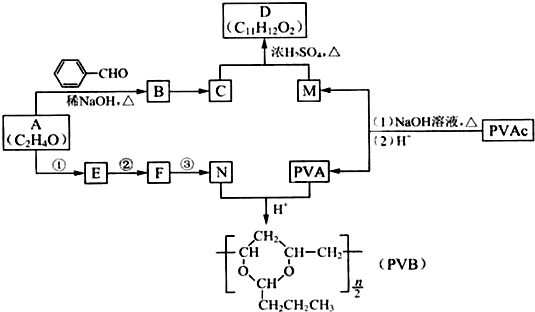
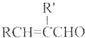 +H2O(R、R′表示烃基或氢)
+H2O(R、R′表示烃基或氢)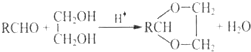
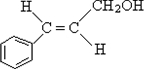 .
.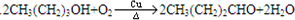 .
.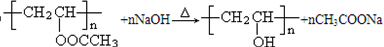 .
.