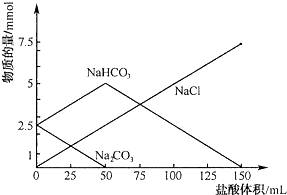
题目内容
7.我国政府为了消除碘缺乏病,规定在食盐中必须加入适量的碘酸钾.检验食盐中是否加碘,可利用如下反应:KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O(1)该反应中氧化剂是KIO3(填化学式).
(2)用双线桥表示该反应电子转移的方向和数目.
KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O
(3)如果反应中转移0.2mol电子,则生成I2的物质的量为0.12mol.
(4)利用上述反应检验食盐中是否加碘,所需试剂是②③④(填选项序号).
①碘水 ②KI溶液 ③淀粉溶液 ④稀硫酸 ⑤AgNO3溶液.
分析 KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O中,I元素的化合价由+5价降低为0,I元素的化合价由-1价升高为0,该反应中转移5e-,结合淀粉遇碘单质变蓝来解答.
解答 解:(1)KIO3中I元素的化合价降低,则KIO3为氧化剂,故答案为:KIO3;
(2)氧化还原反应KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O中,化合价升高值=化合价降低值=转移电子数=5e-,用双线桥表示该反应电子转移的方向和数目为: ,故答案为:
,故答案为: ;
;
(3)在上述反应中,转移5mol电子生成碘单质的量是3mol,所以如果反应中转移0.2mol电子,则生成I2的物质的量为0.2mol×$\frac{3}{5}$=0.12moL,故答案为:0.12mol;
(4)食盐中加碘加的是碘酸钾,可以将碘酸根离子转化为碘单质,需要一种还原剂(碘化钾)来实现,再根据碘单质遇到淀粉显示蓝色来检验,在酸性环境下,碘酸根离子和碘离子之间反应生成碘单质,所以选择的试剂有:KI溶液、淀粉溶液、稀硫酸,
故答案为:②③④.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意电子转移的计算及表示方法,题目难度不大.

练习册系列答案
相关题目
15.由乙醇制取乙二酸乙二酯的流程途径需经下列反应,其顺序正确的是 ①水解反应 ②加成反应 ③氧化反应 ④消去反应 ⑤酯化反应( )
| A. | ①②③④⑤ | B. | ④②①③⑤ | C. | ②①③④⑤ | D. | ④②③①⑤ |
2. 某蓄电池如图所示,以多硫化钠(Na2Sx)、溴化钠(NaBr)水溶液为电解液及电池电化学反应活性物质,电池充放电所发生的反应为2NaBr+(x-1)Na2Sx$?_{充电}^{放电}$Br2+xNa2S(x-1),x为2~4.下列有关判断错误的是( )
某蓄电池如图所示,以多硫化钠(Na2Sx)、溴化钠(NaBr)水溶液为电解液及电池电化学反应活性物质,电池充放电所发生的反应为2NaBr+(x-1)Na2Sx$?_{充电}^{放电}$Br2+xNa2S(x-1),x为2~4.下列有关判断错误的是( )
 某蓄电池如图所示,以多硫化钠(Na2Sx)、溴化钠(NaBr)水溶液为电解液及电池电化学反应活性物质,电池充放电所发生的反应为2NaBr+(x-1)Na2Sx$?_{充电}^{放电}$Br2+xNa2S(x-1),x为2~4.下列有关判断错误的是( )
某蓄电池如图所示,以多硫化钠(Na2Sx)、溴化钠(NaBr)水溶液为电解液及电池电化学反应活性物质,电池充放电所发生的反应为2NaBr+(x-1)Na2Sx$?_{充电}^{放电}$Br2+xNa2S(x-1),x为2~4.下列有关判断错误的是( )| A. | 电池放电时M为负极 | |
| B. | 电池放电时,N极区c(Na+)不断增加 | |
| C. | 电池充电时,A应接外电源的负极 | |
| D. | 电池充电时N极的电极反应式为(x-1)Sx2-+2e-═xS(x-1)2- |
12.下列化学用语表达错误的是( )
| A. | 环己烷的实验式:CH2 | B. | 四氯化碳分子的球棍模 型: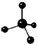 | ||
| C. | HCl的电子式: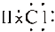 | D. | 氟原子的结构示意图: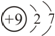 |
19.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,46g有机物C2H6O中含有极性键的数目一定为7NA | |
| B. | 25℃时,1L pH=12的Ba(OH)2溶液中含有的OH-数目为0.02NA | |
| C. | 4.6g Na与足量O2反应后的产物中含离子数目为0.3NA | |
| D. | 标准状况下,2.24L Cl2通入足量H2O反应转移的电子数为0.1NA |
17.设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,11.2 L SO3所含的氧原子数为1.5NA | |
| B. | 电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2NA | |
| C. | 在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA | |
| D. | 常温常压下,7.8 gNa2S和Na2O2的混合物中,阴离子所含电子数为1.8 NA |
 .
.