题目内容
20.孔雀石的主要成分为Cu2(OH)2CO3(难溶),还含少量Fe2O3、SiO2.实验室以孔雀石为原料制备CuCl2•3H2O及CaCO3的步骤如下: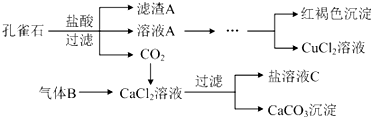
(1)写出孔雀石和盐酸反应的离子方程式Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O.
(2)滤渣A成分的化学式是SiO2,气体B的分子式是NH3.
(3)将CuCl2溶液酸化后,经过加热浓缩、冷却结晶、过滤、洗涤、干燥,得到CuCl2•3H2O晶体.
(4)某种胃药片的治酸剂为CaCO3,该药片中CaCO3质量分数的测定步骤如下(假设其他成分不发生反应):
a.配制0.1mol•L-1的HCl溶液和0.1mol•L-1的NaOH溶液各250mL
b.取0.6g磨碎后的胃药于锥形瓶中
c.向锥形瓶内加入75.00mL 0.1mol•L-1的HCl溶液充分反应
d.用0.1mol•L-1的NaOH溶液与锥形瓶中剩余盐酸反应,恰好消耗15.00mL
①配制上述NaOH溶液所用到的玻璃仪器除烧杯、玻璃棒外还有胶头滴管、250mL容量瓶.
②胃药中碳酸钙的质量分数为50%.
分析 孔雀石的主要成分为Cu2(OH)2CO3,还含少量Fe、Si的化合物,加入稀盐酸反应后生成二氧化碳气体,得到溶液氯化铜溶、氯化亚铁液A,过滤得到二氧化硅固体;然后将Fe2+氧化成Fe3+,再加入CuO固体调节溶液pH沉淀铁离子过滤得到滤液为氯化铜溶液,通过蒸发浓缩,冷却结晶,过滤洗涤得到氯化铜晶体;由工艺流程转化关系可知,应先向CaCl2溶液中加入碱性物质并且不引入新杂质,故气体X应为碱性气体,应为氨气;
(1)孔雀石和盐酸反应生成氯化铜、二氧化碳和水来解答;
(2)过滤得到二氧化硅固体;向CaCl2溶液中加入碱性物质并且不引入新杂质,故气体为氨气;
(3)由溶液制得晶体,应进行蒸发、冷却结晶、过滤等操作;
(4)②根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
②根据盐酸和氢氧化钠的反应,计算出剩余的盐酸的物质的量,用盐酸总的物质的量减去剩余的盐酸的物质的量,就是碳酸钙消耗的盐酸,再计算出碳酸钙的质量分数即可.
解答 解:(1)孔雀石和稀盐酸反应生成氯化铜、二氧化碳和水,反应的离子方程式为:Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O,
故答案为:Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O;
(2)滤渣A成分的化学式是SiO2,气体B的分子式是NH3,
故答案为:SiO2;NH3;
(3)将CuCl2溶液酸化后,经过加热浓缩、冷却结晶、过滤、洗涤、干燥,得到CuCl2•3H2O晶体,
故答案为:冷却结晶;
(4)①根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可知所需的仪器有天平、药匙、烧杯、玻璃棒、250mL容量瓶和胶头滴管,故
所用到的玻璃仪器除烧杯、玻璃棒外还有胶头滴管、250 mL容量瓶;
故答案为:胶头滴管、250 mL容量瓶;
②NaOH+HCl=NaCl+H2O
1 1
CaCO3+2HCl=CaCl2+CO2+H2O
1 2
根据上面两个公式可求得于CaCO3反应的HCl物质的量为:(0.075-0.015)L×0.1mol/L=0.006mol,CaCO3的物质的量为:0.003mol,质量为:0.003mol×100g/mol=0.3g,胃药中碳酸钙的质量分数为:$\frac{0.3g}{0.6g}$×100%=50%,
故答案为:50%.
点评 本题以制备CuCl2•3H2O及CaCO3化学工艺流程图为载体,考查制备方案的设计,题目难度中等,明确实验目的、实验原理为解答关键,试题知识点较多、综合性较强,充分考查了学生的分析能力及化学实验能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 图是2008年北京奥运会的“祥云”火炬,与悉尼奥运火炬所用主要燃料(丁烷)不同,“祥云”火炬所用燃料为丙烷.丙烷和丁烷的沸点如下表:
图是2008年北京奥运会的“祥云”火炬,与悉尼奥运火炬所用主要燃料(丁烷)不同,“祥云”火炬所用燃料为丙烷.丙烷和丁烷的沸点如下表:| 丙烷 | 丁烷 | |
| 沸点/℃ | -42.6 | -0.5 |
| A. | 丙烷燃烧生成的产物无害,是环保型燃料 | |
| B. | 丙烷的沸点比丁烷低,是因为分子间作用力比丁烷弱 | |
| C. | 丙烷在低温时保持的压力比丁烷大 | |
| D. | 丙烷和丁烷都不存在同分异构体 |
| A. | 4Fe2++2I-+3Cl2═4Fe3++I2+6Cl- | |
| B. | 2I-+Cl2═2Cl-+I2 | |
| C. | 2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- | |
| D. | 2Fe2++2I-+2Br-+3Cl2═2Fe3++I2+Br2+6Cl- |
| 阳离子 | Fe2+、Na+、Ba2+、Al3+ |
| 阴离子 | Cl-、SO42-、NO3-、OH- |
(1)A溶液的颜色反应为黄色,则A溶液中含有的金属离子是Na+(填离子序号).
(2)将A的水溶液逐滴加入C中,先生成白色沉淀,后白色沉淀逐渐溶解,请写出白色沉淀逐渐溶解的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(3)B溶液与D溶液反应生成不溶于稀硝酸的白色沉淀,请写出该反应的离子方程式Ba2++SO42-=BaSO4↓.
Ⅱ.(4)据此推断它们是(写化学式)ANaOH;DBa(NO3
)2.
(5)A溶液与B溶液反应的现象为先生成白色絮状沉淀,然后变为灰绿色,最后变为红褐色.
| A. | 制取无水MgCl2,将MgCl2溶液直接蒸干 | |
| B. | 除去CuCl2溶液中含有的少量FeCl2,向溶液中加入过量CuO,待充分反应后过滤 | |
| C. | 的检验:取少量试样于试管中,滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,则试样中含有 | |
| D. | 探究反应的限度:将1mL0.1mol•L-1的KI溶液与5mL0.1mol•L-1的FeCl2溶液混合,待充分反应后,滴加KSCN溶液,观察实验现象 |
| A. | 易溶于水 | B. | 难溶于水 | C. | 属于硅酸盐 | D. | 有颜色 |