题目内容
12.某市对大气进行监测,发现该市首要污染物可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等.因此PM2.5、SO2、NO2等你进行研究具有重要意义.请回答下列问题:(1)对PM2.5样本用适量蒸馏水处理制成待测试样.测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-4 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.
已知:H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ/mol-1
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ/mol-1
写出焦炭与水蒸气反应的热化学方程式:C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJ/mol
②洗涤含SO2的烟气.以下物质可作为洗涤剂的是ab.
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化
①已知气缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0.
若1mol空气含0.8mol N2和0.2mol O2,1300℃时在密闭容器内反应达到平衡.测得NO的物质的量为8×10-4mol,计算该温度下的平衡常数K=4×10-6.汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是温度升高,反应速率加快,平衡右移
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g),已知该反应的△H>0,简述该设想能否实现的依据:因为该反应的△H>0,△S<0,所以任何温度下均不自发进行;
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为2CO+2N0$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.
分析 (1)依据电荷守恒,求出氢离子的浓度,带入pH计算公式;
(2)①利用盖斯定律,通过已知热化学方程式运算得目标热化学方程式;
②依据二氧化硫的性质:是一种酸性氧化物可以和碱反应,二氧化硫溶于水得亚硫酸,酸性强于碳酸,所以可以和碳酸钠溶液反应;
(3)①列三段表示出各种物质平衡时的浓度,带入平衡常数表达式;N2(g)+O2(g)?2NO(g)△H>0,该反应是吸热反应,温度升高,反应速率加快,平衡向正方向移动,单位时间内产生的NO多;
②利用反应能否自发进行的判据△H-T△S;
③CO和NOx在催化剂的作用下发生氧化还原反应生成无毒的二氧化碳和氮气.
解答 解:(1)根据电荷守恒得:[H+]+[K+]+[Na+]+[NH4+]=2[SO42-]+[NO3-]+[Cl-],将表中数据带入得:[H+]=10-4,pH=-lg[H+]=4,溶液呈酸性,
故答案为:酸性;4;
(2)①H2(g)+$\frac{1}{2}$O2(g)=H20 (g)△H=-241.8kJ•mol-1 ①
C(s)+$\frac{1}{2}$O2(g)=CO (g)△H=-110.5kJ•mol-1②
利用盖斯定律将方程式变形:②-①得 C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJ/mol,
故答案为:C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJ/mol;
②二氧化硫是酸性氧化物所以具有酸性氧化物的通性能够与碱反应:SO2+Ca(OH)2=CaSO3↓+H2O;
二氧化硫水溶液是亚硫酸所以也能够与碳酸钠反应:SO2+Na2CO3=Na2SO3+CO2↑所以可以用氢氧化钙溶液和碳酸钠溶液做洗涤剂; 二氧化硫与氯化钙溶液不反应,且在亚硫酸氢钠溶液中的溶解度很小,所以不能用氯化钙和亚硫酸氢钠溶液做洗涤液,
故答案为:ab;
(3)①设反应容器的体积是aL
根据题意得:
N2(g)+O2(g)?2NO(g)
初始浓度 $\frac{0.8}{a}$ $\frac{0.2}{a}$ 0
转化浓度 $\frac{4×1{0}^{-4}}{a}$ $\frac{4×1{0}^{-4}}{a}$ $\frac{8×1{0}^{-4}}{a}$,
平衡浓度 $\frac{0.8}{a}$-$\frac{4×1{0}^{-4}}{a}$ $\frac{0.2}{a}$-$\frac{4×1{0}^{-4}}{a}$ $\frac{8×1{0}^{-4}}{a}$ 将各种物质的浓度带入表达式 得K=$\frac{[NO]^{2}}{[{N}_{2}][{O}_{2}]}$≈4×10-6,
气缸温度越高,单位时间内NO排放量越大,原因是温度升高,反应速率加快,平衡右移;
故答案为:4×10-6;温度升高,反应速率加快,平衡右移;
②2CO(g)=2C(s)+O2(g)是一个熵值减小的反应即:△S<0,同时又是一个△H>O,所以△H-T△S一定大于0,所以任何条件下不能自发进行,
故答案为:因为该反应的△H>0,△S<0,所以任何温度下均不自发进行;
③CO和NOx在催化剂发生反应:2CO+2N0$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2,故答案为:2CO+2N0$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.
点评 本题考查了pH值的计算、盖斯定律求反应热、化学平衡常数的计算、反应进行方向的判断,题目综合性非常强,涉及知识点多,难度中等,同时又结合了环境的污染和治理,题目又比较新颖,是高考的热门话题,解题时应该结合相应的知识,认真解答.

| A. | 现代化学元素分析测试中,可用元素分析仪确定物质中是否含有C、H、O、N、S、Cl、Br等元素,用红外光谱仪确定物质中是否存在某些有机原子团,用原子吸收光谱确定物质中含有哪些金属元素等 | |
| B. | 钠钾合金在常温下是液体,可用于快中子反应堆作剂;镁合金大量用于制造火箭、导弹和飞机的部件等 | |
| C. | 2015年浙江省多地遭遇雾霾天气,有报道称雾霾颗粒中汽车尾气占20%以上,一致汽车尾气中的主要污染物为NOx、CO、燃烧源超细颗粒(PM2.5)等有害物质,其中PM2.5(OM单位为百万分之一米)颗粒大小约等于胶体粒子 | |
| D. | 如图所示为四大基本反应及其关系,则反应4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O属于区域3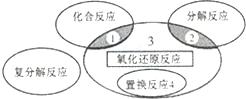 |
| A. | 粒子半径:F-<Mg2+<Al3+ | B. | 热稳定性:HI>HBr>HCl>HF | ||
| C. | 酸性:H2SiO3<H3PO4<H2SO4<HClO4 | D. | 碱性:Al(OH)3>Mg(OH)2>NaOH |
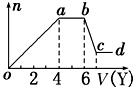 某无色稀溶液X中,可能含有下表所列离子中的某几种.
某无色稀溶液X中,可能含有下表所列离子中的某几种.| 阴离子 | CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
(1)若Y是盐酸,则oa段转化为沉淀的离子(指来源于X溶液的,下同)是AlO2-、SiO32-,ab段发生反应的离子是CO32-,bc段发生反应的离子方程式为Al(OH)3+3H+=Al3++3H2O.
(2)若Y是NaOH溶液,则X中一定含有的阳离子是Al3+、Mg2+、NH4+,其物质的量之比为2:1:4,ab段反应的离子方程式为NH4++OH-═NH3•H2O.
| A. | CCl4和H2S | B. | H2O和NH3 | C. | CH4和CO2 | D. | H2O2和SO2 |
Ⅰ、实验室制取的方法之一是:Ca(OH)2+2HCHO+H2O2=Ca(HCOO)2+2H2O+H2↑.
实验室制取时,将工业用氢氧化钙和甲醛依次加入到质量分数为30-70%的过氧化氢溶液中(投料物质的量之比依次为1:2:1.2),最终可得到质量分数98%以上且重金属含量极低的优质产品.
(1)过氧化氢比理论用量稍多,其目的是使甲醛充分氧化,提高甲醛的利用率和产品纯度;
(2)反应温度最好控制在30-70℃之间,温度不易过高,其主要原因是防止H2O2分解和甲醛挥发;
(3)制备时在混合溶液中要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液,加硫化钠的目的是除去重金属离子;
(4)实验时需强力搅拌45min,其目的是使反应物充分接触,提高产率;结束后需调节溶液的pH 7~8,其目的是防止甲酸钙水解.最后经结晶分离、干燥得产品.
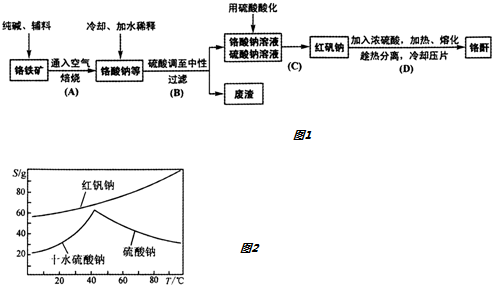
Ⅱ、某研究性学习小组用工业碳酸钙(主要成分为CaCO3;杂质为:Al2O3、FeCO3) 为原料,先制备无机钙盐,再与甲酸钠溶液混合制取甲酸钙.结合右图几种物质的溶解度曲线及表中相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算),现提供的试剂有:a.甲酸钠,b.5mol•L-1硝酸,c.5mol•L-1盐酸,d.5mol•L-1硫酸,e.3%H2O2溶液,f.澄清石灰水.
请补充完整由碳酸钙制备甲酸钙的实验步骤
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
步骤2.用稍过量硝酸溶解碳酸钙样品;
步骤3.用石灰水调整溶液pH=5
步骤4.过滤后,将滤液与甲酸钠溶液混合,调整溶液pH 7~8,充分搅拌,所得溶液经蒸发浓缩、趁热过滤、洗涤、60℃时干燥得甲酸钙晶体.
| A. | 向硫酸铝溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓ | |
| B. | 向Ba(OH)2溶液中滴加NaHSO4溶液至混合溶液恰好为中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| C. | FeSO4溶液与稀硫酸、双氧水混合:2Fe2++H2O2+2H+=2Fe3++2H2O | |
| D. | 向NaHCO3溶液中加入足量Ba(OH)2的溶液:Ba2++2HCO3-+2OH-=2H2O+BaCO3↓+CO32- |
 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.