题目内容
1.甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解.Ⅰ、实验室制取的方法之一是:Ca(OH)2+2HCHO+H2O2=Ca(HCOO)2+2H2O+H2↑.
实验室制取时,将工业用氢氧化钙和甲醛依次加入到质量分数为30-70%的过氧化氢溶液中(投料物质的量之比依次为1:2:1.2),最终可得到质量分数98%以上且重金属含量极低的优质产品.
(1)过氧化氢比理论用量稍多,其目的是使甲醛充分氧化,提高甲醛的利用率和产品纯度;
(2)反应温度最好控制在30-70℃之间,温度不易过高,其主要原因是防止H2O2分解和甲醛挥发;
(3)制备时在混合溶液中要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液,加硫化钠的目的是除去重金属离子;
(4)实验时需强力搅拌45min,其目的是使反应物充分接触,提高产率;结束后需调节溶液的pH 7~8,其目的是防止甲酸钙水解.最后经结晶分离、干燥得产品.
Ⅱ、某研究性学习小组用工业碳酸钙(主要成分为CaCO3;杂质为:Al2O3、FeCO3) 为原料,先制备无机钙盐,再与甲酸钠溶液混合制取甲酸钙.结合右图几种物质的溶解度曲线及表中相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算),现提供的试剂有:a.甲酸钠,b.5mol•L-1硝酸,c.5mol•L-1盐酸,d.5mol•L-1硫酸,e.3%H2O2溶液,f.澄清石灰水.
请补充完整由碳酸钙制备甲酸钙的实验步骤
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
步骤2.用稍过量硝酸溶解碳酸钙样品;
步骤3.用石灰水调整溶液pH=5
步骤4.过滤后,将滤液与甲酸钠溶液混合,调整溶液pH 7~8,充分搅拌,所得溶液经蒸发浓缩、趁热过滤、洗涤、60℃时干燥得甲酸钙晶体.
分析 Ⅰ.(1)化学反应中一种反应物过量目的是促进其他反应物充分反应,提高转化率;
(2)温度较高时,双氧水易分解,甲醛易挥发;
(3)重金属离子与硫离子反应生成难溶的硫化物;
(4)搅拌是使反应物充分接触;甲酸钙水解显碱性,溶液为弱碱性能抑制其水解;
Ⅱ.该实验首先要去除杂质,同时生成可溶性钙盐,杂质中亚铁离子首先要氧化为铁离子(双氧水或硝酸),再生成氢氧化铁除去,铝离子也要生成碱除去,故调节pH为5(用石灰水调节);然后加入甲酸钠溶液混合生成溶解度较小、随温度变化不明显是甲酸钙,经蒸发浓缩,得到甲酸钙固体,趁热过滤,防止其它晶体析出.
解答 解:Ⅰ.(1)化学反应中一种反应物过量目的是促进其他反应物充分反应,提高转化率,则加过量的过氧化氢能使甲醛充分氧化,提高甲醛的利用率和产品纯度;
故答案为:使甲醛充分氧化,提高甲醛的利用率和产品纯度;
(2)温度较高时,双氧水易分解,甲醛易挥发,则反应温度最好控制在30-70℃之间,温度不易过高,能防止H2O2分解和甲醛挥发;
故答案为:防止H2O2分解和甲醛挥发;
(3)制备时在混合溶液中要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液,硫化钠与重金属离子结合生成硫化物,硫化物难溶于水,可以除去重金属离子;
故答案为:除去重金属离子;
(4)搅拌是使使反应物充分接触,使其反应完全,提高产率;甲酸根离子为弱酸根离子,则甲酸钙水解显弱碱性,调节溶液pH 7~8,溶液为弱碱性能抑制甲酸钙水解,故答案为:使反应物充分接触,提高产率;防止甲酸钙水解;
Ⅱ.该实验首先要去除杂质,同时生成可溶性钙盐,杂质中亚铁离子首先要氧化为铁离子(双氧水或硝酸),再生成氢氧化铁除去,铝离子也要生成碱除去,故调节pH为5(用石灰水调节);然后加入甲酸钠溶液混合生成溶解度较小、随温度变化不明显是甲酸钙,经蒸发浓缩,得到甲酸钙固体,趁热过滤,防止其它晶体析出,
则具体的步骤为:
步骤1.称取13.6g甲酸钠溶于约20mL水,配成溶液待用,并称取研细的碳酸钙样品10g待用;
步骤2.用稍过量硝酸溶解碳酸钙样品;
步骤3.用石灰水调整溶液pH=5;
步骤4.过滤后,将滤液与甲酸钠溶液混合,调整溶液pH 7~8,充分搅拌,所得溶液经蒸发浓缩、趁热过滤、洗涤、60℃时干燥得甲酸钙晶体,
故答案为:用稍过量硝酸溶解碳酸钙样品;用石灰水调整溶液pH=5;趁热过滤.
点评 本题是一道实验综合题,主要考查了物质的制备、除杂质、提高产率的方法、实验方案设计,题目难度中等,涉及实验操作目的、原理、步骤等知识,明确实验目的及实验原理为解答关键,试题培养了学生的分析能力及化学实验能力.

①KOH Na2SO4 AlCl3 ②NaHCO3 Ba(OH)2 CuSO4
③HCl NaCl ④Ba(OH)2 Na2CO3 H2SO4.
| A. | ①② | B. | ②③ | C. | ①③④ | D. | ①②④ |
(1)对PM2.5样本用适量蒸馏水处理制成待测试样.测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-4 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.
已知:H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ/mol-1
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ/mol-1
写出焦炭与水蒸气反应的热化学方程式:C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJ/mol
②洗涤含SO2的烟气.以下物质可作为洗涤剂的是ab.
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化
①已知气缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0.
若1mol空气含0.8mol N2和0.2mol O2,1300℃时在密闭容器内反应达到平衡.测得NO的物质的量为8×10-4mol,计算该温度下的平衡常数K=4×10-6.汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是温度升高,反应速率加快,平衡右移
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g),已知该反应的△H>0,简述该设想能否实现的依据:因为该反应的△H>0,△S<0,所以任何温度下均不自发进行;
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为2CO+2N0$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.
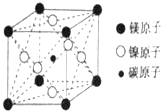 最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性.因这三种元素都是常见元素,从而引起广泛关注.该新型超导晶体的一个晶胞如图所示,则该晶体的化学式为( )
最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性.因这三种元素都是常见元素,从而引起广泛关注.该新型超导晶体的一个晶胞如图所示,则该晶体的化学式为( )| A. | MgCNi3 | B. | Mg2CNi3 | C. | MgCNi2 | D. | MgC2Ni |
| A. | 向淀粉溶液中加入少量的稀硫酸,加热几分钟,冷却后再向该溶液中加入新制Cu(OH)2.没有红色沉淀生产,说明淀粉没有水解 | |
| B. | .向无水乙醇中加入浓H2SO4,加热至170℃,产生的气体通入酸性KMnO4溶液,紫红色褪去. 则使溶液褪色的气体是乙烯 | |
| C. | CO2通入到饱和的Na2CO3溶液中有晶体析出,则晶体为NaHCO3 | |
| D. | 检验Fe2+时,加入KSCN溶液后,发现溶液变红,则Fe2+已被氧化 |
| A. | Ba2+、C1-、$SO_4^{2-}$、K+ | B. | H+、S2-、Na+、NO3- | ||
| C. | Ca2+、$HCO_3^-$、C1-、K+ | D. | Ag+、$NO_3^-$、Cl-、K+ |
| A. | 115号元素位于周期表第八周期 | |
| B. | 该115号的元素的这种核素的原子中,中子数与电子数之差为174 | |
| C. | 1个115号元素的原子与1个12C原子质量之比为115:12 | |
| D. | 115号元素可显+5价 |