题目内容
5. 原子序数依次增大的五种元素A、B、C、D、E位于周期表的前四周期.A基态原子的2p轨道上有2个未成对电子;C的最外层电子数是次外层电子数的3倍,C与D同主族且相邻;E位于周期表的ds区,最外层只有一对成对电子.请回答下列问题:
原子序数依次增大的五种元素A、B、C、D、E位于周期表的前四周期.A基态原子的2p轨道上有2个未成对电子;C的最外层电子数是次外层电子数的3倍,C与D同主族且相邻;E位于周期表的ds区,最外层只有一对成对电子.请回答下列问题:(1)A、B、C三种元素第一电离能最大的是(填元素符号)N,基态E原子的电子排布式为1s22s22p63s23p63d104s2.
(2)C、D的简单氢化物中沸点较高的是H2O(填分子式),原因是水分子间存在氢键.
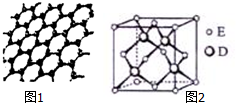
(3)A元素可形成多种单质,其中一种单质为层状结构的晶体(如图1,其原子的杂化轨道类型为sp2.
(4)化合物DC2的立体构型为V形,中心原子的价层电子对数为3.
(5)D与E能形成化合物X,X的一种晶体晶胞结构如图2示,X的化学式为ZnS;若晶胞边长为a,则晶体E的密度计算式为ρ=$\frac{4×97g/mol}{{a}^{3}{N}_{A}}$(NA代表阿伏加德罗常数).
分析 原子序数依次增大的五种元素A、B、C、D、E位于周期表的前四周期,C的最外层电子数是次外层电子数的3倍,则C的最外层有6个电子,C为O元素,C与D同主族相邻,则D为S元素;A基态原子的2p轨道上有2个未成对电子,而且A的原子序数比O小,所以A为C元素;B的原子序数介于A、C之间,所以B为N元素;E位于周期表的ds区,最外层只有一对成对电子,则E为Zn元素;
(1)电子排布为半满状态,较稳定,第一电离能较大;E为Zn元素,Zn的核外有30个电子;
(2)水分子间存在氢键,氢键的作用力大于范德华力;
(3)C形成的单质中层状结构的晶体为石墨,每个C原子形成3个共价单键,所以价层电子对数为3;
(4)根据中心原子的价层电子对数判断;
(5)S在晶胞内部,原子数为4,Zn在顶点和面心,根据均摊法计算;晶胞中处于面心上的Zn原子与2个S原子相连,而该Zn原子被2个晶胞共用;晶胞边长为a,则晶胞的体积为a3,晶胞的质量为$\frac{4×97}{N{\;}_{A}}$,根据ρ=$\frac{m}{V}$计算.
解答 解:原子序数依次增大的五种元素A、B、C、D、E位于周期表的前四周期,C的最外层电子数是次外层电子数的3倍,则C的最外层有6个电子,C为O元素,C与D同主族相邻,则D为S元素;A基态原子的2p轨道上有2个未成对电子,而且A的原子序数比O小,所以A为C元素;B的原子序数介于A、C之间,所以B为N元素;E位于周期表的ds区,最外层只有一对成对电子,则E为Zn元素,
(1)C、N、O三种元素中,N原子的电子排布为半满状态,较稳定,第一电离能较大,所以第一电离能最大的是N;E为Zn元素,Zn的核外有30个电子,其电子排布式为:1s22s22p63s23p63d104s2;
故答案为:N;1s22s22p63s23p63d104s2;
(2)C、D的简单氢化物分别为H2O、H2S,水分子间存在氢键,其沸点比硫化氢高;
故答案为:H2O;水分子间存在氢键;
(3)A为C元素,C形成的单质中层状结构的晶体,该单质为石墨,每个C原子形成3个共价单键,所以价层电子对数为3,其原子的杂化轨道类型为sp2;
故答案为:sp2;
(4)化合物SO2的中S原子的价层电子对数为:2+$\frac{1}{2}$(6-2×2)=3,含有一个孤电子对,所以立体构型为V形;中心原子的价层电子对数为3;
故答案为:V形;3;
(5)S与Zn形成化合物的晶胞中,S在晶胞内部,原子数为4,Zn在顶点和面心,Zn的原子数为$\frac{1}{8}$×8+$\frac{1}{2}$×6=4,所以其化学式为ZnS;晶胞边长为a,则晶胞的体积为a3,晶胞的质量为$\frac{4×97}{N{\;}_{A}}$,所以晶体E的密度为ρ=$\frac{4×97g/mol}{{a}^{3}{N}_{A}}$;
故答案为:ZnS;$\frac{4×97g/mol}{{a}^{3}{N}_{A}}$.
点评 本题考查了物质结构和性质,涉及电离能、氢键、分子结构、杂化轨道、离子方程式、晶胞结构与计算等,为常考知识点,注意掌握中学常见配合物,晶胞结构需要学生具有一定的空间想象能力,侧重对学生综合能量的考查,难度中等.

(1)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊.若产生40.32L(标准状况下)氮气,至少需要叠氮化钠78g.
(2)钠-钾合金可在核反应堆中用作热交换液.5.05g钠-钾合金溶于200mL水生成0.075mol氢气.
①计算溶液中氢氧根离子的物质的量浓度(忽略溶液体积变化).
②计算并确定该钠-钾合金的化学式.
(3)氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液.向该溶液中通入二氧化碳,有下列反应:
2NaAl(OH)4+CO2-→2Al(OH)3↓+Na2CO2+H2O
已知通入二氧化碳336L(标准状况下),生成24mol Al(OH)3和15mol Na2CO3,若通入溶液的二氧化碳为112L(标准状况下),计算生成的Al(OH)3和Na2CO3的物质的量之比.
(4)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失.
| 氢氧化钠质量(g) | 氯化钠质量(g) | |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
| A. | 硫代硫酸钠溶液与稀硫酸反应:2S2O32-+4H+═3S↓+SO42-+2H2O | |
| B. | 在K2Cr2O7的溶液中:Cr2O72-+H2O?2 CrO42-+2H+ | |
| C. | 在KI的溶液滴加稀硫酸:4I-+4H++O2═I2+2H2O | |
| D. | 少量的铁与稀硝酸反应:Fe+4H++NO3-═Fe3++NO↑+2H2O |
| A. | 2g氢气所含原子数目为NA | |
| B. | 1.7g NH3中含N-H键数目为0.1NA | |
| C. | 标准状况下,22.4L单质溴所含有的原子数目为2NA | |
| D. | 1molMg与足量O2或N2反应生成MgO或Mg3N2均失去2NA个电子 |
| A. | BaCl2 NaOH NaHCO3 | B. | AlCl3 NH3•H2O NaOH | ||
| C. | Ba(OH)2 CaCl2 Na2SO4 | D. | Na2CO3 MgCl2 H2SO4 |

 某食用香料乙酸橙花酯的结构简式如图所示,关于该有机物的下列叙述中正确的是( )
某食用香料乙酸橙花酯的结构简式如图所示,关于该有机物的下列叙述中正确的是( )