题目内容
16.(1)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到.第一步:2CH3OH(g)═HCOOCH3(g)+2H2(g)△H>O
第二步:HCOOCH3(g)═CH3OH(g)+CO(g)△H>O
第一步反应的机理可以用图1表示,中间产物X的结构简式为HCHO.
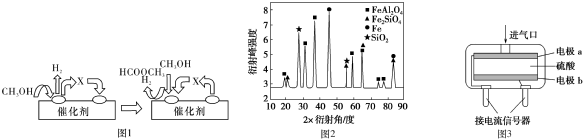
(2)为进行相关研究,用CO还原高铝铁矿石,反应后固体物质的X-射线衍射谱图如图2所示(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同).反应后混合物中的一种产物能与盐酸反应生产两种盐,该反应的离子方程式为:FeAl2O4+8H+=Fe2++2Al3++4H2O.
(3)某催化剂样品(含Ni2O340%,其余为SiO2)通过还原、提纯两步获得镍单质:首先用CO将33.2g样品在加热条件下还原为粗镍;然后在常温下使粗镍中的Ni与CO结合成Ni(CO)4、(沸点43℃),并在180℃时使Ni(CO)4重新分解产生镍单质.上述两步中消耗CO的物质的量之比为3:8.
(4)为安全起见,工业生产中需对空气中的CO进行监测.使用电化学一氧化碳气体传感器定量检测空气中CO含量,其结构如图3 所示.这种传感器利用原电池原理,则该电池的负极反应式为:CO+H2O-2e-=CO2+2H+.
分析 (1)依据分解反应过程和反应机理图示分析判断,中间产物为甲醛;
(2)反应后混合物中的一种产物能与盐酸反应生产两种盐,依据图示中物质组成分析可知是FeAl2O4,反应生成铁盐和铝盐;
(3)依据反应的化学方程式定量关系分析计算;
(4)依据原电池原理分析,测定一氧化碳气体含量,使一氧化碳发生氧化还原反应生成二氧化碳,原电池的负极是失电子发生氧化反应,据此书写负极电极反应.
解答 解:(1)依据图示和分解反应过程,结合原子守恒可知,甲醇去氢后得到的是甲醛,化学式为HCHO,
故答案为:HCHO;
(2)反应后混合物中的一种产物能与盐酸反应生产两种盐,依据图示中物质组成分析可知是FeAl2O4,反应生成铁盐和铝盐,反应的离子方程式为FeAl2O4+8H+=Fe2++2Al3++4H2O,
故答案为:FeAl2O4+8H+=Fe2++2Al3++4H2O;
(3)首先用CO将33.2g样品在加热条件下还原为粗镍;然后在常温下使粗镍中的Ni与CO结合成Ni(CO)4(沸点43℃),并在180℃时使Ni(CO)4重新分解产生镍单质,反应的化学方程式为:Ni2O3+3CO=2Ni+3CO2、Ni+4CO=Ni(CO)4,反应中消耗CO的物质的量之比为3:8,
故答案为:3:8;
(4)测定一氧化碳气体含量,使一氧化碳发生氧化还原反应生成二氧化碳,原电池的负极是失电子发生氧化反应,酸性介质中负极电极反应为:CO+H2O-2e-=CO2+2H+,
故答案为:CO+H2O-2e-=CO2+2H+.
点评 本题考查了离子方程式书写、热化学方程式书的计算、电解原理的应用,题目难度中等,注意掌握离子方程式的书写原则,明确电解原理及其应用方法,试题知识点较多、综合性较强,充分考查了学生的分析能力及灵活应用能力.

 阅读快车系列答案
阅读快车系列答案| A. | Fe2+(Fe3+):加KSCN溶液后过滤 | |
| B. | CO(H2):让气体通过赤热的氧化铜 | |
| C. | C2H4(C2H2):与H2加成 | |
| D. | Cl2(HCl):通过饱和氯化钠水溶液洗涤后收集 |
| A. |  | B. |  | C. |  | D. |  |
| A. | Na2CO3 | B. | NaCl | C. | NH4Cl | D. | CH3COONa |
| A. | X原子的电子层数比Y原子的电子层数少 | |
| B. | 酸性:HXO4>HYO4 | |
| C. | X的气态氢化物比Y的气态氢化物稳定 | |
| D. | Y的单质能将X从NaX的溶液中置换出来 |
| A. | 200mL | B. | 250 mL | C. | 500mL | D. | 560mL |
| A. | 焰色反应属于化学变化 | |
| B. | 做焰色反应实验时可用铂丝或光洁无锈的铁丝 | |
| C. | 焰色反应是元素的性质 | |
| D. | 火焰呈黄色时,样品中可能含有Na+,可能还含有K+ |