题目内容
4.(1)指出氧在下列各物质中的化合价,分别写出由氧气在一定条件下生成下列物质的化学方程式(必须注明反应条件).①Na2O:-2,4Na+O2═2Na2O.
②Na2O2:-1,2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2.
(2)KO2能吸收CO2生成K2CO3和O2,故可用作特殊情况下的氧气源,试写出该反应的化学方程式4KO2+2CO2═2K2CO3+3O2.
(3)人体内O2-对健康有害,使人过早衰老,但在催化剂SOD存在下可以发生如下反应,请完成该反应的离子方程式:□O2-+□H2O═□H2O2+□O2+□□.
分析 (1)钠和氧气反应生成氧化钠;钠在空气中燃烧生成过氧化钠;
(2)KO2能吸收CO2生成K2CO3和O2,根据反应物和生成物及反应条件书写方程式;
(3)根据得失电子守恒配平.
解答 解:(1)钠和氧气反应生成氧化钠,反应方程式为4Na+O2=2Na2O;钠在空气中燃烧生成过氧化钠,反应方程式为2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2,
故答案为:-2;4Na+O2=2Na2O;-1;2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2;
(2)KO2能吸收CO2生成K2CO3和O2,根据反应物和生成物及反应条件知,该反应方程式为4KO2+2CO2=2K2CO3+3O2,故答案为:4KO2+2CO2=2K2CO3+3O2;
(3)根据O2-离子在反应中即升高又减低,即O2-离子在反应中升高为0价变化$\frac{1}{2}$,减低为-1价变化$\frac{1}{2}$,所以氧气和双氧水的系数都为1,O2-离子系数为2,再结合电荷守恒、原子守恒配平,所以离子方程式为:2O2-+2H2O═H2O2+O2+2OH-;故答案为:2O2-+2H2O═H2O2+O2+2OH-.
点评 本题考查钠的重要化合物,涉及氧化还原反应、化合价的判断等知识点,注意过氧化钠、超氧化钾中O元素化合价较特殊,注意生成物与反应条件有关,题目难度不大.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案
相关题目
14.如图为阳离子交换膜法以石墨为电极电解饱和食盐水原理示意图.据图判断下列说法不正确的是( )


| A. | 标准状况下,生成22.4LCl2的同时有2molNaOH生成 | |
| B. | 从C口流出的是NaOH溶液 | |
| C. | 从E口逸出的气体是H2 | |
| D. | 从F口逸出的气体是Cl2 |
15.小东欲配制含有大量下列各离子的溶液,其中能实现的是( )
| A. | K+、H+、SO42-、OH- | B. | Na+、Ca2+、CO32-、NO3- | ||
| C. | Na+、H+、Cl-、CO32- | D. | Na+、Cu2+、Cl-、SO42- |
12.下列实验不能用如图所示装置实现的是( )
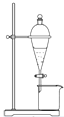

| A. | 用CCl4提取碘水中的碘 | |
| B. | 用水去除硬脂酸钠中的甘油 | |
| C. | 用NaOH溶液除去溴苯中的溴 | |
| D. | 用饱和Na2CO3溶液除去乙酸乙酯中的乙酸 |
19.铁矿石中含铁量的测定,按以下步骤进行:铁矿石中含铁量的测定
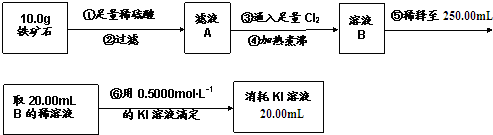
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 步骤④中煮沸的作用是为了除去残留的氯气 | |
| B. | 步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、250mL容量瓶 | |
| C. | 铁矿石中铁的百分含量为56% | |
| D. | 该铁矿石中若含氧为24%,则铁的氧化物的化学式为Fe2O3•3FeO |
16.1L 0.1mol/L AgNO3溶液在以Ag作阳极,Fe作阴极的电解槽中电解,当阴极上增重2.16g时,下列判断中正确的是( )
| A. | 溶液的浓度变为0.08mol/L | B. | 阳极上产生112ml O2 (标准状况) | ||
| C. | 转移的电子数是1.204×1022 个 | D. | 反应中有0.01mol Ag 被氧化 |
13.下列过程不涉及氧化还原反应的是( )
| A. | 古代用铜矿石、锡矿石冶炼铸造青铜器 | |
| B. | 出土后的青铜器大多数已受到锈蚀 | |
| C. | 古代用明矾溶液清除青铜镜表面的锈斑 | |
| D. | 现代用双氧水去除青铜器上有害的CuCl |
14.化学与生活和工农业生产密切相关,下列说法不正确的是 ( )
| A. | Fe2O3俗称铁红,常用作红色油漆和涂料 | |
| B. | 二氧化硫具有漂白性,可用来增白纸浆、草帽辫、食品等,还可用于杀菌消毒 | |
| C. | 废旧钢材焊接前,分别用饱和Na2CO3,NH4Cl溶液处理焊点 | |
| D. | 聚丙烯酸钠树脂广泛应用于植物移栽及制作尿不湿 |



