题目内容
15.小东欲配制含有大量下列各离子的溶液,其中能实现的是( )| A. | K+、H+、SO42-、OH- | B. | Na+、Ca2+、CO32-、NO3- | ||
| C. | Na+、H+、Cl-、CO32- | D. | Na+、Cu2+、Cl-、SO42- |
分析 根据离子之间不能结合生成沉淀、气体、水等,不能相互促进水解等,则离子大量共存,以此来解答.
解答 解:A.H+、OH-结合生成水,不能共存,故A错误;
B.Ca2+、CO32-结合生成沉淀,不能共存,故B错误;
C.H+、CO32-结合生成水和气体,不能共存,故C错误;
D.该组离子之间不反应,可大量共存,故D正确;
故选D.
点评 本题考查离子的共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,题目难度不大.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
5.下列对实验操作的叙述错误的是( )
| A. | 用胶头滴管加液时,不能伸入试管中 | |
| B. | 蒸馏盛在烧瓶中含水的酒精,需在瓶内放一些碎瓷片 | |
| C. | 萃取实验中涉及气体压强原理 | |
| D. | 用容积为100 mL的量筒量取80 mL无水乙醇,使液面最低点至刻度80 mL处 |
6.下列对实验室中试剂储存的有关说法不正确的是( )
| A. | 金属钠存放在试剂瓶中的煤油里 | |
| B. | 存放液溴的试剂瓶中应加水封 | |
| C. | 硝酸应用棕色瓶盛装且避光存放 | |
| D. | 烧碱应盛放在玻璃塞的磨口玻璃瓶中 |
3.近年来AIST报告正在研制一种“高容量、低成本”锂一铜空气燃料电池.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )

| A. | 通空气时,铜被腐蚀,表面产生CuO | |
| B. | 放电时,Li+透过固体电解质向Cu极移动 | |
| C. | 放电时,正极的电极反应式为Cu2O+H2O+2e-═2Cu+2OH- | |
| D. | 整个反应过程中,铜相当于催化剂 |
10.实验室中需用3mol/L 的K2CO3溶液480mL,配置时应选用的容量瓶的规格和称取K2CO3的质量分别为( )
| A. | 1000 mL,514.00 g | B. | 480 mL,198.72 g | ||
| C. | 500 mL,207.00 g | D. | 任意规格,207.00 g |
20.下列说法不正确的是( )
| A. | △H<0、△S>0的反应在任何温度下都能自发进行 | |
| B. | NH4HCO3(s)═NH3 (g)+H2O(g)+CO2(g)△H=+185.57 kJ•mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| C. | 硝酸铵固体的溶解过程与焓变有关 | |
| D. | 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的速率 |
7. 合成氨工业对国民经济和社会发展具有重要的意义,其原理是:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol,
合成氨工业对国民经济和社会发展具有重要的意义,其原理是:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol,
(1)已知合成氨反应在某温度下2L的密闭容器中进行,测得数据如表:
根据表中数据计算:
①0 min~1 min内N2的平均反应速率为0.05mol/(L•min)
②该条件下反应的平衡常数k=0.15(保留两位小数)
③反应达到平衡后,若往平衡体系中再加入N2、H2、NH3各1mol,化学平衡向正向(填“正向”、“逆向”或“不移动”),该反应的平衡常数k不变(填“变大”“减小”或“不变”)
④能表明该反应达到平衡状态的是B(选填序号)
A.N2的转化率等于NH3的产率 B.混合气体的平均相对分子质量不变
C.v(N2)与v(H2)的比值不变 D.混合气体的密度不变
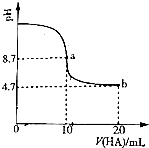
(2)室温下向10mL0.3mol/LNaOH溶液中加入0.3mol/L的一元酸HA溶液pH的变化曲线如图,下列说法正确的是CE.
A.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.b点所示溶液中c(A-)>c(HA)
D.pH=7时,c(Na+)=c(A-)+c(HA)
E.b点所示溶液中c(HA)+c(A-)=0.2mol/L.
 合成氨工业对国民经济和社会发展具有重要的意义,其原理是:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol,
合成氨工业对国民经济和社会发展具有重要的意义,其原理是:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol,(1)已知合成氨反应在某温度下2L的密闭容器中进行,测得数据如表:
| 不同时间各物质的物质的量/mol | |||||
| 0min | 1min | 2min | 3min | 4min | |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
①0 min~1 min内N2的平均反应速率为0.05mol/(L•min)
②该条件下反应的平衡常数k=0.15(保留两位小数)
③反应达到平衡后,若往平衡体系中再加入N2、H2、NH3各1mol,化学平衡向正向(填“正向”、“逆向”或“不移动”),该反应的平衡常数k不变(填“变大”“减小”或“不变”)
④能表明该反应达到平衡状态的是B(选填序号)
A.N2的转化率等于NH3的产率 B.混合气体的平均相对分子质量不变
C.v(N2)与v(H2)的比值不变 D.混合气体的密度不变
(2)室温下向10mL0.3mol/LNaOH溶液中加入0.3mol/L的一元酸HA溶液pH的变化曲线如图,下列说法正确的是CE.
A.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.b点所示溶液中c(A-)>c(HA)
D.pH=7时,c(Na+)=c(A-)+c(HA)
E.b点所示溶液中c(HA)+c(A-)=0.2mol/L.
5.下列说法中正确的是( )
| A. | 分别与滴有酚酞的NaOH溶液共热可区别煤油与植物油 | |
| B. | 煤含有苯、甲苯等,先干馏后分馏获可得苯、甲苯等芳香烃 | |
| C. | 在水电离出H+浓度为1×10-12mol/L溶液中一定大量存在Fe2+、Na+、NO3-、Cl- | |
| D. | 在NH4HSO3溶液中加入少量NaOH溶液反应的离子方程式为NH4++OH-=NH3•H2O |