题目内容
18.设NA表示阿伏加德罗常数的数值,则下列叙述正确的是( )| A. | 1 mol HCl气体所含H+数目为NA | |
| B. | 1 mol CO2气体含有的C═O键数为NA | |
| C. | 4.6 g分子式为C2H6O的有机物,所含C-H键数目一定为0.5NA | |
| D. | 1 mol Na2O2所含的阴阳离子总数为3NA |
分析 A.氯化氢气体不含氢离子;
B.1个二氧化碳与两个氧原子分别形成一个C=O键;
C.C2H6O可以为甲醚,也可以是乙醇;
D.过氧化钠阴离子为过氧根离子.
解答 解:A.氯化氢气体不含氢离子,故A错误;
B.1 mol CO2气体含有的C═O键数为2NA,故B错误;
C.46g分子式为C2H6O的物质的量为1mol,若C2H6O为甲醚,1mol中含有6mol碳氢极性键,若是乙醇,含有5molC-H键,故C错误;
D.1mol Na2O2含有2mol钠离子,1mol过氧根离子,共含有的阴阳离子总数为3NA,故D正确;
故选:D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,注意二氧化碳、过氧化钠、乙醇的结构组成,题目难度中等.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案
相关题目
8.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.2NA | |
| B. | 2 L 0.5mol•L-1硫酸钾溶液中阴离子所带电荷数为NA | |
| C. | 18g H2O含有10NA个质子 | |
| D. | 标准状况下,11.2L苯中含有分子的数目为0.5NA |
9.物质的量的浓度的单位是( )
| A. | g/L | B. | mol/L | C. | g/mol | D. | mol |
6.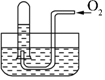 如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管.当向试管内鼓入氧气后,可以观察到试管中水柱继续上升,经过多次重复后,试管内完全被水充满,原来试管中盛装的可能是什么气体( )
如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管.当向试管内鼓入氧气后,可以观察到试管中水柱继续上升,经过多次重复后,试管内完全被水充满,原来试管中盛装的可能是什么气体( )
 如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管.当向试管内鼓入氧气后,可以观察到试管中水柱继续上升,经过多次重复后,试管内完全被水充满,原来试管中盛装的可能是什么气体( )
如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管.当向试管内鼓入氧气后,可以观察到试管中水柱继续上升,经过多次重复后,试管内完全被水充满,原来试管中盛装的可能是什么气体( )| A. | 可能是N2与NO2的混合气体 | B. | 可能是O2与NO2的混合气体 | ||
| C. | 一定是NO与NO2的混合气体 | D. | 只可能是NO2一种气体 |
13.同类晶体物质熔、沸点的变化是有规律的,试分析下列两组物质熔点规律变化的原因:
晶体熔、沸点的高低,决定于组成晶体微粒间的作用力的大小.A组是①离子晶体,晶体微粒之间通过②离子键相连,粒子之间的作用力由大到小的顺序是 ③NaCl>KCl>CsCl.B组晶体属于 ④金属晶体,价电子数由少到多的顺序是 ⑤Na<Mg<Al,离子半径由大到小的顺序是 ⑥Na+>Mg2+>Al3+.金属键强度由小到大的顺序为 ⑦Na<Mg<Al.
| A组物质 | 熔点/K | B组物质 | 熔点/K |
| NaCl | 1 074 | Na | 317 |
| KCl | 1 049 | Mg | 923 |
| CsCl | 918 | Al | 933 |
11.某体积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反应:A(g)+3B(g)?2C(g).若维持温度和压强不变,当达到平衡时容器的体积为V,其中C气体的体积占10%.下列推断正确的是( )
| A. | 原混合气体的体积为1.2V | B. | 原混合气体的体积为1.1V | ||
| C. | 反应达平衡时气体B消耗掉0.05V | D. | 反应达到平衡时气体A消耗掉0.05V |
8.反应Cu2++Zn=Cu+Zn2+可在溶液中进行完全,由该反应可判断Cu2+的氧化性强于( )
| A. | Zn | B. | Cu | C. | Zn2+ | D. | Cu+ |
9.下列各组离子在指定溶液中能大量共存的是( )
| A. | 能使红色石蕊试纸变蓝的溶液中:Na+、K+、NO3-、AlO2- | |
| B. | 在含有大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- | |
| C. | 在加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- | |
| D. | 能使湿润的淀粉碘化钾试纸变蓝的溶液中:Na+、NH4+、S2-、Br- |