题目内容
20.标准状况下,33.6L HCl气体溶于水配成1L溶液,则溶液中溶质的物质的量浓度为1.5 mol/L.分析 根据n=$\frac{V}{{V}_{m}}$计算HCl的物质的量,再根据c=$\frac{n}{V}$计算盐酸的物质的量浓度.
解答 解:33.6LHCl气体的物质的量为$\frac{33.6L}{22.4L/mol}$=1.5mol,溶于水配成1L溶液,故所得溶液的物质的量浓度为$\frac{1.5mol}{1L}$=1.5mol/L,
故答案为:1.5.
点评 本题考查物质的量的相关计算,准确运用n=$\frac{V}{{V}_{m}}$,c=$\frac{n}{V}$是解题的关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.下列说法错误的是( )


| A. | 酒精可以和水以任意比例互溶,与氢键有关 | |
| B. | 邻羟基苯甲醛的沸点低于对羟基苯甲醛的沸点,与氢键有关 | |
| C. | 无机含氧酸的化学式可以用XOn(OH)m表示,n值越大,则该酸的酸性就越强.则可推知,硫酸酸性强于磷酸 | |
| D. | 如图该分子中没有手性碳原子 |
10.2016年诺贝尔化学奖授予在“分子机器设计和合成”领域有突出成就的三位科学家,有机物甲和乙为“分子马达”的关键组件.下列说法正确的是( )


| A. | 甲是苯的同系物,乙不是苯的同系物,甲乙瓦为同分异构体 | |
| B. | 甲、乙均能发生取代反应和加成反应 | |
| C. | 甲的一氯代物有2种,乙的一氯代物有7种(不考虑顺反异构) | |
| D. | 甲分子中所有原了可能在同一平面上,乙分子中所有原了一定在同一平面上 |
8.T℃时,在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g).反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示.则下列结论不正确的是( )
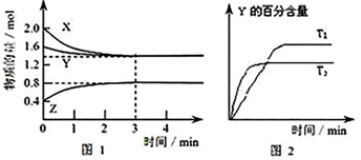

| A. | 容器中发生的反应可表示为:3X(g)+Y(g)?2Z(g) | |
| B. | 反应进行的前3 min内,用X表示的反应速率 v(X)=0.3mol/(L•min) | |
| C. | 据图2可知,相对于T1,温度为T2时更快达到“拐点”,说明T2时化学反应速率更快,可确定温度T2高于T1 | |
| D. | 若改变反应条件,使反应进程如图3所示,则改变的条件可能是使用了催化剂 |
15.下列微粒中同时具有离子键、共价键和配位键的化合物是( )
| A. | NH4Cl | B. | Na2O2 | C. | H3O+ | D. | MgO |
5.下列说法正确的是( )
| A. | SiO2是酸性氧化物,能与碱溶液反应 | |
| B. | Na2CO3和NaHCO3都是盐,都能与酸溶液反应 | |
| C. | CO和NO都是大气污染物,在空气中都能稳定存在 | |
| D. | Al在浓盐酸中会“钝化”,能用铝槽盛放浓盐酸 |
10.能在水溶液中大量共存的一组离子是( )
| A. | H+、Fe3+、I-、SO${\;}_{4}^{2-}$ | B. | OH-、Na+、HCO${\;}_{3}^{-}$、Cl- | ||
| C. | K+、Ca2+、NO${\;}_{3}^{-}$、SiO${\;}_{3}^{2-}$ | D. | K+、Na+、OH-、AlO${\;}_{2}^{-}$ |
 ,B的分子式C7H6O2,C的一种同分异构体的结构简式CH3CH2NO2.
,B的分子式C7H6O2,C的一种同分异构体的结构简式CH3CH2NO2.