题目内容
 金属及其化合物在生产、生活中有广泛应用.
金属及其化合物在生产、生活中有广泛应用.(1)从结构角度分析Fe3+较Fe2+稳定的原因
(2)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂.据此判断三氯化铁晶体属于
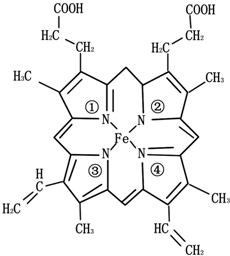
(3)铁元素为血红蛋白和肌红蛋白的活性部分---血红素的重要组成元素,血红素的结构简式如图所示.与铁原子形成配位键的是
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和CrO2中,更适合作录音带磁粉原料的是
考点:配合物的成键情况,不同晶体的结构微粒及微粒间作用力的区别
专题:化学键与晶体结构
分析:(1)Fe3+较Fe2+稳定,3d电子不同,半满为稳定结构;
(2)根据题干中氯化铁的物理性质分析分析其晶体类型;
(3)N原子提供孤对电子形成配位键;
(4)金属阳离子含未成对电子越多,则磁性越大,根据离子的最外层电子数判断未成对电子.
(2)根据题干中氯化铁的物理性质分析分析其晶体类型;
(3)N原子提供孤对电子形成配位键;
(4)金属阳离子含未成对电子越多,则磁性越大,根据离子的最外层电子数判断未成对电子.
解答:
解:(1)Fe3+较Fe2+稳定,是因Fe3+的3d能级为3d5半充满状态,较稳定,
故答案为:Fe3+的3d能级为3d5半充满状态,较稳定;
(2)常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂,则三氯化铁为分子晶体,
故答案为:分子;
(3)N原子提供孤对电子形成配位键,由血红素的结构简式的图示可知,①④形成的是配位键,
故答案为:①④;
(4)V2O5中V的最外层电子全部失去或成键,CrO2中Cr失去4个电子,离子的最外层电子为2,为成对,离子含未成对电子越多,则磁性越大,则适合作录音带磁粉原料的是CrO2,
故答案为:CrO2.
故答案为:Fe3+的3d能级为3d5半充满状态,较稳定;
(2)常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂,则三氯化铁为分子晶体,
故答案为:分子;
(3)N原子提供孤对电子形成配位键,由血红素的结构简式的图示可知,①④形成的是配位键,
故答案为:①④;
(4)V2O5中V的最外层电子全部失去或成键,CrO2中Cr失去4个电子,离子的最外层电子为2,为成对,离子含未成对电子越多,则磁性越大,则适合作录音带磁粉原料的是CrO2,
故答案为:CrO2.
点评:本题考查较为综合,涉及电子排布、化学键、晶体类型等多个方面的知识,注意把握电子排布式的书写、配位键的判断方法,侧重物质结构与性质的考查,题目难度较大.

练习册系列答案
相关题目
将5mol?L-1盐酸10mL稀释到200mL,此时溶液的物质的量浓度是( )
| A、0.05mol?L-1 |
| B、0.25mol?L-1 |
| C、0.1mol?L-1 |
| D、0.5mol?L-1 |
NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、标准状况下,2.24L Cl2与过量NaOH溶液反应,转移的电子总数为0.2NA |
| B、0.1mol Na2O2中阴阳离子的数目均为0.2 NA |
| C、分子数为NA 的CO、C2H4混合气体的质量为28g,体积约为22.4L |
| D、盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5mol |
NA表示阿伏加德罗常数,下列说法正确的是( )
| A、1mol H2和O2的混合气体中含NA个分子 |
| B、含1mol HCl的盐酸中离子总数为NA个 |
| C、标准状况下11.2L的水中含有0.5个NA水分子 |
| D、在常温常压下,含0.5NA个N原子的氮气所占的体积约为11.2L |
 氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O?HCl+HClO,K=4.5×10-4,次氯酸的强氧化性能杀死水中的病菌(不直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大).但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代.请回答:
氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O?HCl+HClO,K=4.5×10-4,次氯酸的强氧化性能杀死水中的病菌(不直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大).但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代.请回答: