题目内容
(1)4.5g水与 g硫酸所含的分子数相等.
(2)等体积的NaCl、MgCl2、AlCl3三种溶液,分别加入等量的AgNO3溶液,恰好都完全反应,则以上三种溶液的物质的量浓度之比为 .
(3)200mL 的Al2(SO4)3溶液中,SO42-的物质的量浓度为2.00mol/L,Al3+的物质的量浓度为 ,含有 mol Al2(SO4)3.
(4)5.6L标准状况下的氨气溶于水配成500mL溶液,所得溶液的物质的量浓度为 ,
(5)100mL98%的浓硫酸,密度为1.84g/mL稀释成200mL.求稀释后溶液的物质的量浓度 .
(2)等体积的NaCl、MgCl2、AlCl3三种溶液,分别加入等量的AgNO3溶液,恰好都完全反应,则以上三种溶液的物质的量浓度之比为
(3)200mL 的Al2(SO4)3溶液中,SO42-的物质的量浓度为2.00mol/L,Al3+的物质的量浓度为
(4)5.6L标准状况下的氨气溶于水配成500mL溶液,所得溶液的物质的量浓度为
(5)100mL98%的浓硫酸,密度为1.84g/mL稀释成200mL.求稀释后溶液的物质的量浓度
考点:物质的量浓度的相关计算,物质的量的相关计算
专题:计算题
分析:(1)当物质的物质的量相同时,其分子数就相等,利用n=
进行计算;
(2)根据与等量的AgNO3溶液,恰好都完全反应,则等体积的NaC1、MgCl2、A1Cl3三种溶液中Cl-的物质的量相等,以此来计算;
(3)根据硫酸铝的化学式及硫酸根离子的物质的量浓度计算出铝离子的浓度;根据化学式组成计算出硫酸铝的浓度,再计算出硫酸铝的物质的量;
(4)根据n=
计算出5.6L氨气的物质的量,再根据c=
计算出氨水的物质的量浓度;
(5)根据c=
计算出浓硫酸的物质的量浓度,再根据稀释前后溶质的物质的量不变 计算出稀释后溶液的物质的量浓度.
| m |
| M |
(2)根据与等量的AgNO3溶液,恰好都完全反应,则等体积的NaC1、MgCl2、A1Cl3三种溶液中Cl-的物质的量相等,以此来计算;
(3)根据硫酸铝的化学式及硫酸根离子的物质的量浓度计算出铝离子的浓度;根据化学式组成计算出硫酸铝的浓度,再计算出硫酸铝的物质的量;
(4)根据n=
| V |
| 22.4L/mol |
| n |
| V |
(5)根据c=
| 1000ρω |
| M |
解答:
解:(1)设硫酸的质量为x,二者的分子数相等,则水与硫酸的物质的量相等,
则
=
,
解得:x=24.5g,
故答案为:24.5;
(2)设NaCl、MgCl2、AlCl3的物质的量分别为x、y、z,
由分别加入等量的AgNO3溶液,恰好都完全反应,则种溶液中Cl-的物质的量相等,
x=y×2=3z,
解得:x:y:z=6:3:2,
因溶液的体积相同,则物质的量之比等于浓度之比,
所以浓度之比为6:3:2,
故答案为:6:3:2;
(3)200mL 的Al2(SO4)3溶液中,SO42-的物质的量浓度为2.00mol/L,则Al3+的物质的量浓度为:c(Al3+)=
c(SO42-)=
mol/L;
溶液中硫酸铝的物质的量为:n(Al2(SO4)3)=
c(Al3+)×0.2L=
×
mol/L×0.2L=
mol,
故答案为:
mol/L;
;
(4)标准状况下5.6L氨气的物质的量为:
=0.25mol,0.4mol氨气溶于水配成500mL溶液,所得溶液的物质的量浓度为:
=0.5mol/L,
故答案为:0.5mol/L;
(5)100mL98%的浓硫酸,密度为1.84g/mL稀释成200mL,该浓硫酸的物质的量浓度为:c=
mol/L=18.4mol/L,
100mL该浓硫酸稀释成200mL稀硫酸过程中,硫酸的物质的量不变,则稀释后溶液的浓度为:
=9.2mol/L,
故答案为:9.2mol/L.
则
| 4.5g |
| 18g/mol |
| x |
| 98g/mol |
解得:x=24.5g,
故答案为:24.5;
(2)设NaCl、MgCl2、AlCl3的物质的量分别为x、y、z,
由分别加入等量的AgNO3溶液,恰好都完全反应,则种溶液中Cl-的物质的量相等,
x=y×2=3z,
解得:x:y:z=6:3:2,
因溶液的体积相同,则物质的量之比等于浓度之比,
所以浓度之比为6:3:2,
故答案为:6:3:2;
(3)200mL 的Al2(SO4)3溶液中,SO42-的物质的量浓度为2.00mol/L,则Al3+的物质的量浓度为:c(Al3+)=
| 2 |
| 3 |
| 4 |
| 3 |
溶液中硫酸铝的物质的量为:n(Al2(SO4)3)=
| 1 |
| 2 |
| 1 |
| 2 |
| 4 |
| 3 |
| 2 |
| 15 |
故答案为:
| 4 |
| 3 |
| 2 |
| 15 |
(4)标准状况下5.6L氨气的物质的量为:
| 5.6L |
| 22.4L/mol |
| 0.25mol |
| 0.5L |
故答案为:0.5mol/L;
(5)100mL98%的浓硫酸,密度为1.84g/mL稀释成200mL,该浓硫酸的物质的量浓度为:c=
| 1000×1.84×98% |
| 98 |
100mL该浓硫酸稀释成200mL稀硫酸过程中,硫酸的物质的量不变,则稀释后溶液的浓度为:
| 18.4mol/L×0.1L |
| 0.2L |
故答案为:9.2mol/L.
点评:本题考查了有关物质的量浓度的计算,题目难度中等,注意掌握物质的量浓度的概念及表达式,明确物质的量与摩尔质量、物质的量浓度、标况下的气体摩尔体积之间的关系,试题培养了学生的分析、理解能力及化学计算能力.

练习册系列答案
相关题目
下列物质分类正确的是( )
| A、SO2、SiO2、CO均为酸性氧化物 |
| B、稀豆浆、雾、氯化钠溶液均可形成胶体 |
| C、烧碱、冰醋酸、四氯化碳均为电解质 |
| D、盐酸、溴水、氨水均为混合物 |
已知OCN-中每种元素原子都满足8电子稳定结构,反应OCN-+OH-+C12→CO2+N2+C1-+H2O(未配平)中,如果有9mol C12完全反应,则被氧化的OCN-的物质的量为( )
| A、2mol | B、3mol |
| C、4mol | D、6mol |
 金属及其化合物在生产、生活中有广泛应用.
金属及其化合物在生产、生活中有广泛应用.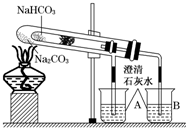 “套管实验”是将一支较小的试管装入另一试管中,经组装来完成原来需要两只或更多试管进行的实验.因其有许多优点,近年来被广泛开发并应用于化学实验中.下面这个实验为“套管实验”,实验装置中,小试管中部有沾上无水硫酸铜粉末的脱脂棉.请观察实验装置,分析实验原理,并回答下列问题:
“套管实验”是将一支较小的试管装入另一试管中,经组装来完成原来需要两只或更多试管进行的实验.因其有许多优点,近年来被广泛开发并应用于化学实验中.下面这个实验为“套管实验”,实验装置中,小试管中部有沾上无水硫酸铜粉末的脱脂棉.请观察实验装置,分析实验原理,并回答下列问题:
