题目内容
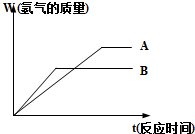 等质量的两种金属粉末A、B分别与同浓度的足量稀盐酸反应,都生成+2价金属氯化物,其反应情况如图所示:
等质量的两种金属粉末A、B分别与同浓度的足量稀盐酸反应,都生成+2价金属氯化物,其反应情况如图所示:(1)两种金属的活动性顺序是
(2)将两种金属粉末按一定比例混合后,进行甲、乙丙三组实验,三组实验各取500mL同浓度的盐酸溶液加入该种混合粉末,产生气体,有关数据如下:
| 实验序号 | 甲 | 乙 | 丙 |
| 混合粉末质量(g) | 6.2 | 18.6 | 24.8 |
| 生成气体气体(mL) | 2240 | 5600 | 5600 |
②上述所用的盐酸的物质的量浓度为
考点:有关混合物反应的计算,化学方程式的有关计算
专题:计算题
分析:(1)从图可知,B与盐酸的曲线的斜率要大,这个斜率就是反应的速率大小,所以两种金属的活动性顺序是B>A,等质量的A、B与同浓度的足量稀盐酸反应,A放出的氢气多(看最后平台对应的纵坐标),所以A的摩尔质量要小;
(2)①甲组实验,后面随着金属的量增加,放出的气体增加,故甲组是盐酸过量,乙组实验中,金属质量是甲组的3倍,如果金属全都反应完,产生的气体应该是甲组的3倍,而给出的数据是小于3倍,很明显乙组中的盐酸已经不足了;
②计算最终生成氢气的物质的量,根据H原子守恒计算n(HCl),进而计算c(HCl);
甲组实验中金属完全反应,金属都为+2价,根据电子转移守恒,金属物质的量等于氢气物质的量,则金属的平均摩尔质量═金属的质量÷气体的物质的量.
(2)①甲组实验,后面随着金属的量增加,放出的气体增加,故甲组是盐酸过量,乙组实验中,金属质量是甲组的3倍,如果金属全都反应完,产生的气体应该是甲组的3倍,而给出的数据是小于3倍,很明显乙组中的盐酸已经不足了;
②计算最终生成氢气的物质的量,根据H原子守恒计算n(HCl),进而计算c(HCl);
甲组实验中金属完全反应,金属都为+2价,根据电子转移守恒,金属物质的量等于氢气物质的量,则金属的平均摩尔质量═金属的质量÷气体的物质的量.
解答:
解:(1)从图可知,B与盐酸的曲线的斜率要大,这个斜率就是反应的速率大小,所以两种金属的活动性顺序是B>A,等质量的A、B与同浓度的足量稀盐酸反应,A放出的氢气多(看最后平台对应的纵坐标),所以A的摩尔质量要小,
故答案为:B>A;B>A;
(2)①甲组实验,后面随着金属的量增加,放出的气体增加,故甲组是盐酸过量,乙组实验中,金属质量是甲组的3倍,如果金属全都反应完,产生的气体应该是甲组的3倍,而给出的数据是小于3倍,很明显乙组中的盐酸已经不足了,
故答案为:不足量;
②最终生成氢气的物质的量为
=0.25mol,根据H原子守恒n(HCl)=0.25mol×2=0.5mol,所以c(HCl)=
=1mol/L;
甲组实验中金属完全反应,金属都为+2价,根据电子转移守恒,金属物质的量等于氢气物质的量,此时生成氢气为
=0.1mol,故金属的平均摩尔质量═6.2g÷0.1mol=62g/mol,
故答案为:1;62g/mol.
故答案为:B>A;B>A;
(2)①甲组实验,后面随着金属的量增加,放出的气体增加,故甲组是盐酸过量,乙组实验中,金属质量是甲组的3倍,如果金属全都反应完,产生的气体应该是甲组的3倍,而给出的数据是小于3倍,很明显乙组中的盐酸已经不足了,
故答案为:不足量;
②最终生成氢气的物质的量为
| 5.6L |
| 22.4L/mol |
| 0.5mol |
| 0.5L |
甲组实验中金属完全反应,金属都为+2价,根据电子转移守恒,金属物质的量等于氢气物质的量,此时生成氢气为
| 2.24L |
| 22.4L/mol |
故答案为:1;62g/mol.
点评:本题考查学生的识图及处理实验数据的能力,难度中等,(2)中注意根据气体体积与固体质量关系确定反应过量问题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
一系列物质:NaCl、Cl2、NaClO、Cl2O5、HClO4是按某一规律排列的,下列组合中也完全照此规律排列的是( )
| A、Na2CO3 C CO2 CO NaHCO3 |
| B、Na2S S SO2 Na2SO3 Na2SO4 |
| C、NH4Cl N2 NaNO2 NO2 HNO3 |
| D、P2O5 H3PO4 Na3PO4 Na2HPO4 NaH2PO4 |
20g由两种金属粉末组成的混合物,与足量的盐酸充分反应后得到11.2L氢气(标准状况),这种金属混合物的组成可能是( )
| A、Mg和Al |
| B、Al和Fe |
| C、Fe和Zn |
| D、Zn和Cu |
用U形管做电解槽,惰性电极电解Na2CO3溶液,阳极和阴极所收集气体的体积比为(气体经干燥,并在同温同压下测量)( )
| A、1:2 | B、2:1 |
| C、略大于1:2 | D、略大于2:1 |
一定条件下存在反应:CO(g)+H2O(g)?CO2(g)+H2(g),其正反应放热.现有三个相同的2L恒温恒容密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1mol CO和1mol H2O,在Ⅱ中充入1mol CO2 和1mol H2,在Ⅲ中充入2mol CO 和2mol H2O,700℃条件下开始反应.达到平衡时,下列说法不正确的是( )
| A、容器Ⅰ、Ⅱ中正反应速率相同 |
| B、容器Ⅰ、Ⅲ中反应的平衡常数相同 |
| C、容器Ⅰ中CO 的转化率与容器Ⅱ中CO2 的转化率之和等于1 |
| D、容器Ⅰ中CO 的物质的量比容器Ⅱ中的多 |
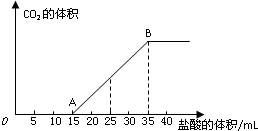 将一定体积的CO2通入到50mL某浓度的NaOH溶液中,得到溶液甲.为了测定其溶液甲的成分,向该溶液甲中加入1mol/L的盐酸,所加入的盐酸与产生CO2的体积(标况)的关系如图所示:
将一定体积的CO2通入到50mL某浓度的NaOH溶液中,得到溶液甲.为了测定其溶液甲的成分,向该溶液甲中加入1mol/L的盐酸,所加入的盐酸与产生CO2的体积(标况)的关系如图所示: 用惰性电极电解一定浓度的食盐水时,通过电子的物质的量与生成气体总物质的量的关系如图所示(不考虑氯气的溶解).若电解结束时,通过电子总物质的量为4mol,电解后恢复至常温,溶液的体积为2L,则混合气体中氢气的物质的量为
用惰性电极电解一定浓度的食盐水时,通过电子的物质的量与生成气体总物质的量的关系如图所示(不考虑氯气的溶解).若电解结束时,通过电子总物质的量为4mol,电解后恢复至常温,溶液的体积为2L,则混合气体中氢气的物质的量为