题目内容
20.NA为阿伏加德罗常数的值.下列叙述正确的是( )| A. | 16 g O2和O3 的混合气体中含有的分子数为0.5 NA | |
| B. | 25℃时,Ksp(BaSO4)=1×10-10,则BaSO4饱和溶液中Ba2+数日为1×10-5 NA | |
| C. | 标准状况下,2.24 L Cl2 通入足量H2O或NaOH溶液中转移的电子数均为0.1 NA | |
| D. | 常温下,1 mol的NaHCO3固体中含HCO3-的数目为NA |
分析 A、如果16 g O2全是氧气分子数为0.5 NA,而是O2和O3 的混合气体;
B、溶液的体积不知,所以无法求BaSO4饱和溶液中Ba2+的物质的量;
C、氯气与水反应是可逆反应,氯气未完全转化;
D、1 mol的NaHCO3固体中含有1 mol的碳酸氢根离子和1mol的钠离子.
解答 解:A、如果16 g O2全是氧气分子数为0.5 NA,而是O2和O3 的混合气体,所以分子数小于0.5 NA,故A错误;
B、25℃时,Ksp(BaSO4)=1×10-10,BaSO4饱和溶液中Ba2+的浓度为1×10-5 mol/L,而溶液的体积不知,所以无法求BaSO4饱和溶液中Ba2+的物质的量,故B错误;
C、氯气与水反应是可逆反应,氯气未完全转化,所以标准状况下,2.24 L Cl2 通入足量H2O中转移电子的数目小于0.1mol,故C错误;
D、1 mol的NaHCO3固体中含有1 mol的碳酸氢根离子和1mol的钠离子,所以1 mol的NaHCO3固体中含HCO3-的数目为NA,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数,涉及溶度积的计算、物质的量的相互转化,明确氯气与水反应是可逆反应,没有完全转化是解题的关键.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
11.能说明二氧化硫具有还原性的事实是( )
| A. | 使品红溶液褪色 | B. | 使溴水褪色 | C. | 与氢硫酸反应 | D. | 与烧碱反应 |
15.下列事实与水解反应无关的是( )
| A. | 用Na2S除去废水中的Hg2+ | B. | 用热的Na2CO3溶液去油污 | ||
| C. | 利用油脂的皂化反应制造肥皂 | D. | 配制CuSO4溶液时加少量稀H2SO4 |
5.已知A、B、C、D、E是短周期中原子序数依次增大的五种主族元素,其中A是组成有机物的必要元素,元素B的原子最外层电子数是其电子层数的3倍,元素D与A为同族元素,元素C与E形成的化合物CE是厨房常用调味品.下列说法正确的是( )
| A. | 原子半径:C>D>B>A | |
| B. | C与B形成的两种化合物均属于离子化合物,且化学键类型完全相同 | |
| C. | 最简单气态氢化物的稳定性:B>A | |
| D. | A、D、E的最高价氧化物对应水化物的酸性逐渐增强 |
19.某混合物的水溶液中可能含有以下离子中的若干种:Na+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、SO42-,现分别取100mL的两份溶液进行如下实验.
①第一份加过量NaOH溶液后加热,收集到0.01mol气体,无沉淀生成,同时得到溶液甲.
②向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧后,得到1.02g固体.
③第二份加足量BaCl2溶液后,生成白色沉淀,过滤后的沉淀经足量盐酸洗涤、干燥后,得到11.65g固体,向滤液中加入AgNO3溶液又有白色沉淀产生.下列有关叙述正确的是( )
①第一份加过量NaOH溶液后加热,收集到0.01mol气体,无沉淀生成,同时得到溶液甲.
②向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧后,得到1.02g固体.
③第二份加足量BaCl2溶液后,生成白色沉淀,过滤后的沉淀经足量盐酸洗涤、干燥后,得到11.65g固体,向滤液中加入AgNO3溶液又有白色沉淀产生.下列有关叙述正确的是( )
| A. | 由①可知原溶液存在离子为NH4+,其浓度为0.01mol/L | |
| B. | 原溶液一定存在Cl- | |
| C. | 原溶液肯定没有Fe3+、Mg2+,一定含有Na+ | |
| D. | n(NH4+):n(Al3+):n(SO42-)=1:1:5 |
20.科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术:2H2O$?_{TiO_{2}}^{激光}$2H2↑+O2↑.制得的氢气可用于燃料电池.
(1)分解海水时,实现了从太阳能转变为化学能.生成的氢气用于燃料电池时,实现化学能转变为电能.
通常把拆开1mol 某化学键所吸收的能量或形成1mol某化学键所放出的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热,化学反应的反应热等于反应中断裂旧化学键的之和与反应中形成新化学键的键能之和的差.
(2)估算1mol N和 3mol H结合生成1mol NH3放出热量为45.4KJ.在一定条件下,N2和H2合成NH3,该反应为放热反应(填“放热”或“吸热”),每生成2mol NH3反应的热值为90.8KJ.
(1)分解海水时,实现了从太阳能转变为化学能.生成的氢气用于燃料电池时,实现化学能转变为电能.
通常把拆开1mol 某化学键所吸收的能量或形成1mol某化学键所放出的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热,化学反应的反应热等于反应中断裂旧化学键的之和与反应中形成新化学键的键能之和的差.
| 化学键 | H-H | N≡N | N-H |
| 键能/KJ•mol-1 | 436 | 946 | 390.8 |
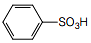 (6)氯仿 (7)三氯甲烷(8)臭氧(9)氧气
(6)氯仿 (7)三氯甲烷(8)臭氧(9)氧气