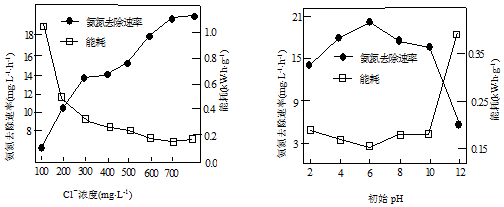
题目内容
15.下列事实与水解反应无关的是( )| A. | 用Na2S除去废水中的Hg2+ | B. | 用热的Na2CO3溶液去油污 | ||
| C. | 利用油脂的皂化反应制造肥皂 | D. | 配制CuSO4溶液时加少量稀H2SO4 |
分析 A.硫离子与汞离子结合生成难溶性的HgS;
B.纯碱为强碱弱酸盐,水解呈碱性,油脂在碱性条件下水解;
C.油脂在碱性条件下的水解反应是皂化反应;
D.CuSO4在溶液中水解生成少量H2SO4.
解答 解:A.硫离子与汞离子结合生成难溶性的HgS,所以能用Na2S除去废水中的Hg2+,与与水解反应无关,故A选;
B.纯碱为强碱弱酸盐,水解呈碱性,加热碱性增强,可使油污在碱性条件下水解而除去,与盐类的水解有关,故B不选;
C.油脂在碱性条件下的水解反应是皂化反应,能生成肥皂,所以利用油脂的皂化反应制造肥皂,与盐类的水解有关,故C不选;
D.CuSO4在溶液中水解生成少量H2SO4,加少量稀H2SO4能抑制CuSO4的水解,所以配制CuSO4溶液时加少量稀H2SO4,与盐类的水解有关,故D不选.
故选A.
点评 本题考查盐类水解的应用,侧重于化学知识的综合运用的考查,注意把握盐类水解的原理,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.二氧化氯(ClO2)是极易溶于水且不发生化学反应的黄绿色气体,沸点为11℃,可用于处理含硫废水.某小组在实验室中探究ClO2与Na2S的反应.回答下列问题:
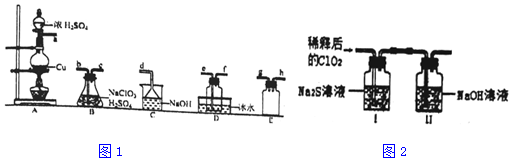
(1)ClO2的制备(已知SO2+2NaClO3+H2SO4═2ClO2↑+2NaHSO4)置A中反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+H2O.
②欲收集干燥的ClO2,选择图1中的装置,其连接顺序为a→g→h→b→c→e→f→d(按气流方向,用小写字母表示)
③装置D的作用是冷凝并收集ClO2.
(2)ClO2与Na2S的反应
将上述收集到的ClO2用N2稀释以增强其稳定性,并将适量的稀释后的ClO2通入图2所示装置中充分反应,得到无色澄清溶液.一段时间后,通过下列实验探究I中反应的产物.
④ClO2与Na2S反应的离子方程式为8ClO2+5S2-+4H2O=8Cl-+5SO42-+8H+.

(1)ClO2的制备(已知SO2+2NaClO3+H2SO4═2ClO2↑+2NaHSO4)置A中反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+H2O.
②欲收集干燥的ClO2,选择图1中的装置,其连接顺序为a→g→h→b→c→e→f→d(按气流方向,用小写字母表示)
③装置D的作用是冷凝并收集ClO2.
(2)ClO2与Na2S的反应
将上述收集到的ClO2用N2稀释以增强其稳定性,并将适量的稀释后的ClO2通入图2所示装置中充分反应,得到无色澄清溶液.一段时间后,通过下列实验探究I中反应的产物.
| 操作步骤 | 实验现象 | 结论 |
| 取少量I中溶液于试管甲中,滴加品红溶液和盐酸 | 品红始终不褪色 | ①无_SO2(或HSO3-或SO32-)生成 |
| 另取少量I中溶液于试管乙中,加入Ba(OH)2溶液,振荡 | ②白色沉淀 | 有SO42- |
| ③继续在试管乙中滴加Ba(OH)2溶液至过量,静置,取上层清液于试管丙中,________ | 有白色沉淀生成 | 有Cl-生成 |
6.NA为阿伏加德罗常数的值.下列有关叙述正确的是( )
| A. | 标准状况下,2.24 L C12与足量铁粉反应转移的电子数为0.2NA | |
| B. | 2 L 0.1 mol•L-1Na2CO3溶液中所含CO32-的数目为0.2NA | |
| C. | 28 g C2H4所含共用电子对数目为4NA | |
| D. | 1 mol H2O中所含的中子数为10NA |
3.化学与人类生产、生活、环境等密切相关,下列说法正确的是( )
| A. | 用加酶洗衣粉洗衣服时水的温度越高越好 | |
| B. | “光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化物有关 | |
| C. | 小苏打是制作馒头的膨松剂,苏打是治疗胃酸过多的抗酸剂 | |
| D. | 乙醇、过氧化氢、次氯酸钠等消毒液的消毒原理都是利用其强氧化性 |
10.化学与生产、生活等密切相关,下列说法正确的是( )
| A. | 纤维素进入人体内会完全水解为葡萄糖从而为人体提供能量 | |
| B. | 含有食品添加剂的食物对人体均有害 | |
| C. | 硫酸铝可除去水体中的悬浮杂质并起到消毒杀菌的作用 | |
| D. | 含氮、磷元素的化合物大量排入江河湖泊中会导致水体富营养化 |
20.NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 16 g O2和O3 的混合气体中含有的分子数为0.5 NA | |
| B. | 25℃时,Ksp(BaSO4)=1×10-10,则BaSO4饱和溶液中Ba2+数日为1×10-5 NA | |
| C. | 标准状况下,2.24 L Cl2 通入足量H2O或NaOH溶液中转移的电子数均为0.1 NA | |
| D. | 常温下,1 mol的NaHCO3固体中含HCO3-的数目为NA |
7.薄荷醇的结构简式如图,下列说法正确的是( )
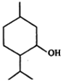

| A. | 薄荷醇分子中至少有12个碳原子共平面 | |
| B. | 薄荷醇分子式为C10H20O,它是环戊醇的同系物 | |
| C. | 1mol薄荷醇与足量NaHCO3反应生成22.4LCO2(标准状况) | |
| D. | 在一定条件下,薄荷醇能发生取代、中和、氧化等反应 |