题目内容
 根据电化学知识回答下列问题.
根据电化学知识回答下列问题.①茫茫黑夜中,航标灯为航海员指明了方向.航标灯的电源必须长效、稳定.我国科技工作者研制出以铝合金、Pt-Fe合金网为电极材料的海水电池.在这种电池中
②如图是制备Cu2O的电解池示意图,电解总反应为:2Cu+H2O
| 通电 |
考点:原电池和电解池的工作原理
专题:
分析:①根据电极材料的活泼性判断两极,铝较铁活泼,所以铝作负极发生氧化反应,Pt-Fe合金作正极发生还原反应,海水为电解质溶液,据此分析;
②根据电解总反应为2Cu+H2O
Cu2O+H2↑,可以知道金属铜为阳极材料,在阳极发生失电子的氧化反应,在阴极上是氢离子发生得电子的还原反应,根据电极方总反应判断OH-的浓度的变化.
②根据电解总反应为2Cu+H2O
| ||
解答:
解:①根据电极材料的活泼性判断两极,铝较铁活泼,所以铝作负极发生氧化反应,Pt-Fe合金作正极发生还原反应,海水为电解质溶液,发生反应的化学方程式即正反应为铝被氧气氧化生成氧化铝,方程式为:4Al+3O2═2Al2O3;故答案为:铝合金;海水;4Al+3O2═2Al2O3;
②根据电解总反应为2Cu+H2O
Cu2O+H2↑,可以知道金属铜为阳极材料,在阳极发生失电子的氧化反应,在阴极上是氢离子发生得电子的还原反应,所以石墨电极发生还原反应,根据电极方总反应,消耗水,则溶液中OH-的浓度增大,故答案为:还原;增大;
②根据电解总反应为2Cu+H2O
| ||
点评:本题考查学生原电池和电解池的工作原理,注意阴阳极的判断及电极反应式的书写,要求学生熟记教材知识,并会灵活运用,题目难度不大.

练习册系列答案
相关题目
用惰性电极电解CuSO4溶液一段时间后,停止电解向所得溶液中加入0.2molCu(OH)2,恰好反应时溶液浓度恢复至电解前,关于电解过程说法不正确的是( )
| A、生成的铜的物质的量是0.2mol |
| B、随着电解进行溶液的pH减小 |
| C、转移电子的物质的量为0.4mol |
| D、阳极反应是40H--4e-=2H20+O2尹 |
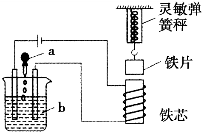 如图所示,向烧杯内的溶液b中逐渐加入溶液a时,灵敏弹簧秤的读数先逐渐变小然,然后又逐渐变大,则溶液a、b分别是( )
如图所示,向烧杯内的溶液b中逐渐加入溶液a时,灵敏弹簧秤的读数先逐渐变小然,然后又逐渐变大,则溶液a、b分别是( )| A、NaOH、H2SO4 |
| B、BaCl2、NaOH |
| C、Ba(OH)2、Na2SO4 |
| D、NH3?H2O、CH3COOH |
下列说法正确的是( )
| A、镀锌铁和镀锡铁的镀层破损后,前者较易被腐蚀 |
| B、火电是将燃料中的化学能直接转化为电能的过程 |
| C、将煤粉碎了再燃烧可以提高煤的燃烧效率 |
| D、化学反应的限度不可以通过改变条件而改变 |
炽热的炉膛内有反应:C(s)+O2(g)=CO2(g)△H=-392kJ/mol,往炉膛内通入水蒸气时,有如下反应:C(s)+H2O(g)=CO(g)+H2(g)△H=+131kJ/mol,CO(g)+
O2(g)=CO2(g)△H=-282kJ,H2(g)+
O2(g)=H2O(g)△H=-241kJ/mol,由以上反应推断往炽热的炉膛内通入水蒸气时( )
| 1 |
| 2 |
| 1 |
| 2 |
| A、不能节省燃料,但能使炉火瞬间更旺 |
| B、虽不能使炉火更旺,但可以节省燃料 |
| C、既能使炉火更旺,又能节省燃料 |
| D、既不能使炉火更旺,又不能节省燃料 |
 室温下,用0.1mol/LHCl滴定10mL0.1mol/LNa2CO3,滴定曲线如图所示.下列说法正确的是( )
室温下,用0.1mol/LHCl滴定10mL0.1mol/LNa2CO3,滴定曲线如图所示.下列说法正确的是( )| A、水电离程度由大到小的顺序为:a>b>c>d |
| B、a点时:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) |
| C、b点时:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) |
| D、d点时:c(H+)>c(HCO3-)=c(CO32-) |