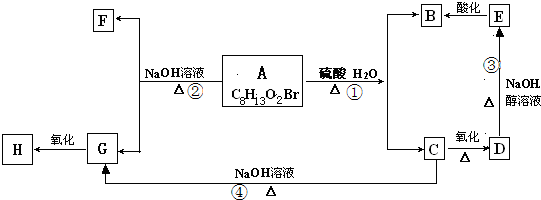
题目内容
14.标准状况下,67.2L N2O4有3mol氧原子,有6mol氮原子,有18NA个原子,有138mol电子,有138NA个质子.分析 根据n=$\frac{V}{{V}_{m}}$=$\frac{N}{{N}_{A}}$结合物质的构成解答该题.
解答 解:n(N2O4)=$\frac{67.2L}{22.4L/mol}$=3mol,则含有12molO,6molN,共18NA个原子,电子数为3mol×(7×2+8×4)=138mol,质子数为138NA,
故答案为:3;6;18NA;138;138NA.
点评 本题考查了以物质的量为中心的计算,为高频考点,侧重于学生的分析、计算能力的考查,题目难度不大,注意把握相关计算公式的运用以及物质的构成特点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.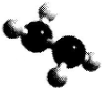 肼(N2H2)是火箭常用的高能燃料,常温下为液体,其球棍模型如图所示.肼能与双氧
肼(N2H2)是火箭常用的高能燃料,常温下为液体,其球棍模型如图所示.肼能与双氧
水发生反应:NH2+2H2O2═N2+4H2O.用NA表示阿伏伽德罗常数,下列说法正确
的是( )
 肼(N2H2)是火箭常用的高能燃料,常温下为液体,其球棍模型如图所示.肼能与双氧
肼(N2H2)是火箭常用的高能燃料,常温下为液体,其球棍模型如图所示.肼能与双氧水发生反应:NH2+2H2O2═N2+4H2O.用NA表示阿伏伽德罗常数,下列说法正确
的是( )
| A. | 标准状况下,11.2LN2中含电子总数为5 NA | |
| B. | 标准状况下,22.4LN2 H4 中所含原子总数为6 NA | |
| C. | 标准状况下,3.2gN 2H4 中含有共价键的总数为0.6 NA | |
| D. | 若生成3.6gH2 O,则上述反应转移电子的数目为0.2 NA |
2.如表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下说法正确的是( )
| 元素符号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | L2+与R2-的核外电子数相等 | |
| B. | M与L形成的最高价氧化物对应水化物的碱性:L>M | |
| C. | 氢化物的稳定性为H2T<H2R | |
| D. | 单质与等浓度的稀盐酸反应的速率为Q>L |
6.在恒温恒容的密闭容器中充入适量HI,发生如下反应2HI(g)?H2(g)+I2(g),达到平衡后,分离出部分H2(g)时,下列说法中正确的是( )
| A. | I2的量减少 | B. | 平衡逆向移动 | C. | ν(正)>ν(逆) | D. | HI转化率不变 |
3.将1.92g铜粉与足量硝酸反应,收集到1.12L(标况)气体,则消耗的硝酸的物质的量是( )
| A. | 0.09mol | B. | 0.11mol | C. | 0.12mol | D. | 0.2mol |
4.下列离子方程式中,能正确表示盐的水解反应的是( )
| A. | NH4++H2O?NH3•H2O+H+ | B. | Fe3++3H2O═Fe(OH)3↓+3H+ | ||
| C. | S2-+2H2O═H2S+2OH- | D. | Br-+H2O═HBr+OH- |