题目内容
6.在恒温恒容的密闭容器中充入适量HI,发生如下反应2HI(g)?H2(g)+I2(g),达到平衡后,分离出部分H2(g)时,下列说法中正确的是( )| A. | I2的量减少 | B. | 平衡逆向移动 | C. | ν(正)>ν(逆) | D. | HI转化率不变 |
分析 达到平衡后,分离出部分H2(g)时,生成物浓度减小,则平衡正向移动,以此来解答.
解答 解:达到平衡后,分离出部分H2(g)时,生成物浓度减小,则平衡正向移动,
A.平衡正向移动,可知I2的量增加,故A错误;
B.由上述分析可知,平衡正向移动,故B错误;
C.平衡正向移动可知ν(正)>ν(逆),故C正确;
D.平衡正向移动可知HI的转化率增大,故D错误;
故选C.
点评 本题考查化学平衡的移动,为高频考点,把握减小生成物的浓度平衡正向移动为解答的关键,侧重分析与应用能力的考查,注意平衡移动的影响因素,题目难度不大.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
16.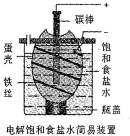 某化学课外学习小组设计电解饱和食盐水的简易装置如图(蛋壳内及壳外容器均充满饱和食盐水).有关说法正确的是( )
某化学课外学习小组设计电解饱和食盐水的简易装置如图(蛋壳内及壳外容器均充满饱和食盐水).有关说法正确的是( )
 某化学课外学习小组设计电解饱和食盐水的简易装置如图(蛋壳内及壳外容器均充满饱和食盐水).有关说法正确的是( )
某化学课外学习小组设计电解饱和食盐水的简易装置如图(蛋壳内及壳外容器均充满饱和食盐水).有关说法正确的是( )| A. | 通电一段时间后,往蛋壳内溶液中滴加几滴酚酞,呈红色 | |
| B. | 蛋壳表面缠绕的铁丝发生氧化反应 | |
| C. | 碳棒上产生的气体能使湿润的淀粉碘化钾试纸变蓝 | |
| D. | 电解一段时间后,蛋壳外溶液的pH下降 |
17.某化学小组拟采用如下装置(夹持和加热仪器已略去)来电解饱和食盐水,并用电解产生的H2还原CuO粉末来测定Cu的相对原子质量,同时验证氯气的氧化性.
(1)写出甲中反应的化学方程式2NaCl+2H2O $\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.

(2)为完成上述实验,正确的连接顺序为A接E,B接C(填接口字母).
(3)乙装置中X试剂可以是KI淀粉溶液,丙装置中Y试剂的作用是吸收氢气中的水.
将w g CuO置于硬质玻璃管中,按以下方案测得的数据计算Cu的相对原子质量.
(4)按此方案计算,得到Cu的相对原子质量是$\frac{18w-16b+16a}{b-a}$.
(5)下列情况将使测定结果偏大的是ac
a.CuO未完全还原为Cu b.CuO受潮
c.CuO中混有Cu d.碱石灰吸收了空气中的CO2和H2O
(6)如仍采用上述装置,请再设计一个方案,测定Cu的相对原子质量:将w g CuO置于硬质玻璃管中,分别称取反应前后硬质玻璃管和固体的质量.
(1)写出甲中反应的化学方程式2NaCl+2H2O $\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.

(2)为完成上述实验,正确的连接顺序为A接E,B接C(填接口字母).
(3)乙装置中X试剂可以是KI淀粉溶液,丙装置中Y试剂的作用是吸收氢气中的水.
将w g CuO置于硬质玻璃管中,按以下方案测得的数据计算Cu的相对原子质量.
| 反应前质量/g | 反应后质量/g | |
| U型管+固体 | a | b |
(5)下列情况将使测定结果偏大的是ac
a.CuO未完全还原为Cu b.CuO受潮
c.CuO中混有Cu d.碱石灰吸收了空气中的CO2和H2O
(6)如仍采用上述装置,请再设计一个方案,测定Cu的相对原子质量:将w g CuO置于硬质玻璃管中,分别称取反应前后硬质玻璃管和固体的质量.
1.下列广告用语符合科学性的是( )
| A. | 这种饮料中不含任何化学物质 | |
| B. | 这种蒸馏水绝对纯净,不含任何离子 | |
| C. | 这种口服液含有丰富的氮、磷、锌等微量元素 | |
| D. | 没有水就没有生命 |
11.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1molFeCl3与沸水反应生成的胶体中含有NA个Fe(OH)3胶粒 | |
| B. | 1.12LNH3所含的原子数是0.2NA | |
| C. | 常温常压下,0.4molNa2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4NA | |
| D. | 1molNa2O2晶体中共含有4NA个离子 |
16.200℃时,11.6g CO2和H2O的混合物气体与足量的Na2O2反应,反应后固体增加了3.6g,则原混合物的平均相对分子质量为( )
| A. | 5.8 | B. | 11.6 | C. | 23.2 | D. | 36.4 |
