题目内容
7.下列各物质溶液显酸性的是( )| A. | NaHCO3 | B. | CH3COONa | C. | NaCl | D. | NH4Cl |
分析 这几种物质都属于盐,根据“谁强谁显性、谁弱谁水解”来判断溶液的酸碱性.
解答 解:A.碳酸氢钠属于强碱弱酸酸式盐,碳酸氢根离子水解程度大于电离程度,所以碳酸氢钠溶液呈碱性,故A错误;
B.醋酸钠属于强碱弱酸盐,醋酸根离子水解而使其溶液呈碱性,故B错误;
C.氯化钠属于强酸强碱盐,其溶液呈中性,故C错误;
D.氯化铵属于强酸弱碱盐,铵根离子水解而使溶液呈酸性,故D正确;
故选D.
点评 本题考查了盐类水解,根据盐中存在的弱离子及弱离子水解程度大小判断溶液的酸碱性,题目难度不大.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
17.取三张蓝色石蕊试纸湿润后贴在玻璃片上,然后按顺序分别滴加浓硝酸、98.3%的浓硫酸、新制氯水,三张试纸最终变成( )
| A. | 白、红、白 | B. | 红、黑、白 | C. | 红、红、红 | D. | 白、黑、白 |
18.用Cl2生产某些含氯有机物时会产生副产物HCl,利用反应4HCl+O2$?_{400℃}^{CuO/CuCl_{2}}$2Cl2+2H2O可实现氯的循环利用.已知:
Ⅰ.反应中,4 mol HCl被氧化放出115.6 kJ 的热量;
Ⅱ.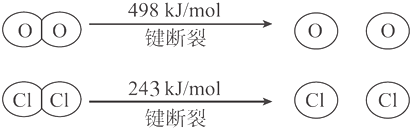
则断开1molH-O键与断开1molH-Cl键所需能量相差约为( )
Ⅰ.反应中,4 mol HCl被氧化放出115.6 kJ 的热量;
Ⅱ.

则断开1molH-O键与断开1molH-Cl键所需能量相差约为( )
| A. | 12kJ | B. | 32kJ | C. | 115.6kJ | D. | 127.6kJ |
2.在25.00ml碱式滴定管中盛有溶液,液面恰好在20.00ml刻度处,现将滴定管中全部溶液放出,流入量筒内,所得溶液体积为( )
| A. | 5mL | B. | 20mL | C. | 大于5mL | D. | 小于5mL |
19.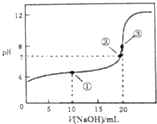 常温下,用0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1CH3COOH溶液所得曲线如图.下列说法正确的是( )
常温下,用0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1CH3COOH溶液所得曲线如图.下列说法正确的是( )
 常温下,用0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1CH3COOH溶液所得曲线如图.下列说法正确的是( )
常温下,用0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1CH3COOH溶液所得曲线如图.下列说法正确的是( )| A. | 滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | |
| B. | ①处水的电离程度大于②处水的电离程度 | |
| C. | ②处加入的NaOH溶液恰好将CH3COOH中和 | |
| D. | ③处所示溶液:c(Na+)<c(CH3COO-) |
 .
.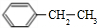 、
、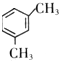 .
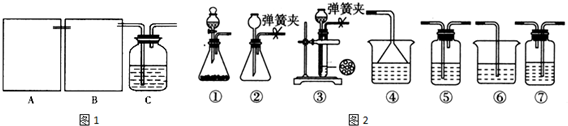
.
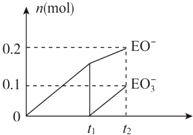 有A、B、C、D、E、F六种短周期元素,其元素特征信息如下:
有A、B、C、D、E、F六种短周期元素,其元素特征信息如下: