题目内容
14.分子式为C8H16O2的有机物A,它能在酸性条件下水解生成B和C,且B在一定条件下能转化成C.则有机物A的可能结构有( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
分析 分子式为C8H16O2的有机物A,它能在酸性条件下水解生成B和C,则说明A应为酯,B在一定条件下能转化成C,则B为醇,C为酸,B能被氧化为酸,则B中含有-CH2OH,根据C3H7-的结构判断.
解答 解:分子式为C8H16O2的有机物A,它能在酸性条件下水解生成B和C,因B在一定条件下可氧化成C,则B为C3H7CH2OH、C为C3H7COOH,因C3H7-有CH3CH2CH2-和CH3CH(CH3)-两种结构,则有机物A有2种,
故选A.
点评 本题考查了同分异构体的书写方法,题目难度不大,注意根据B转化为C的性质和C3H7-的同分异构体的种类判断,明确同分异构体的书写原则为解答关键,试题培养了学生的灵活应用能力.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
6.下列关于有机物的性质或应用说法不正确的是( )
| A. | 苯和油脂均不能使酸性KMnO4褪色 | |
| B. | CH2Cl2只有一种结构说明甲烷分子是正四面体结构,而不是平面正方形结构 | |
| C. | 蒸馏和分馏都是通过沸点不同分离液态混合物的 | |
| D. | 油脂皂化反应的产物是高级脂肪酸和甘油 |
2.在一个密闭容器中有N2和H2,在一定条件下反应.10min后测得NH3的浓度为2mol•L-1,则在这10min内NH3的平均反应速率是( )
| A. | 0.1 mol•L-1•min-1 | B. | 0.2 mol•L-1•min-1 | ||
| C. | 0.3 mol•L-1•min-1 | D. | 0.6 mol•L-1•min-1 |
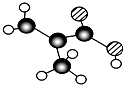 ,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).
,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).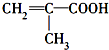 .
.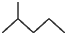 表示的有机物C的分子式为C6H14.
表示的有机物C的分子式为C6H14.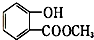 中含有的官能团的名称为羟基、酯基.
中含有的官能团的名称为羟基、酯基.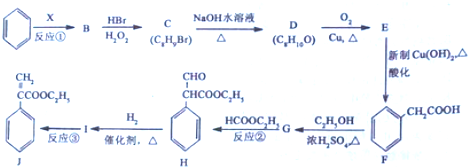
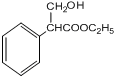 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$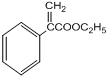 +H2O,反应类型是消去反应.
+H2O,反应类型是消去反应.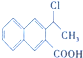 为起始原料制备
为起始原料制备 的合成路线(无机试剂任用).合成路线示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
的合成路线(无机试剂任用).合成路线示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.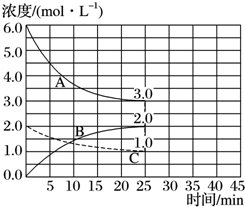 (1)目前工业合成氨的原理是N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ•mol-1.
(1)目前工业合成氨的原理是N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ•mol-1.