题目内容
3.下列说法正确的是( )| A. | 在SiO2晶体中,1个Si原子和2个O原子形成两条共价键 | |
| B. | 由多种非金属元素组成的化合物一定是共价化合物 | |
| C. | HF、HCl、HBr、HI四种物质的沸点依次升高 | |
| D. | 晶体熔化时化学键不一定发生断裂 |
分析 A、SiO2是原子晶体,每个Si原子与4个O原子成键;
B、氯化铵是多种非金属元素形成的离子化合物;
C、氟化氢分子与分子之间存在氢键,所以沸点异常的高;
D、分子晶体熔化破坏分子间作用力.
解答 解:A、SiO2晶体中每个Si原子与4个O原子成键,故A错误;
B、氯化铵是多种非金属元素形成的离子化合物,所以由多种非金属元素组成的化合物不一定是共价化合物,故B错误;
C、氟化氢分子与分子之间存在氢键,所以沸点异常的高,则HCl、HBr、HI、HF沸点依次升高,故C错误;
D、分子晶体熔化破坏分子间作用力,离子晶体熔化破坏离子键,则晶体熔化时,化学键不一定发生断裂,故D正确;
故选D.
点评 本题考查较综合,涉及化学键、氢键、熔沸点的高低,为高频考点,把握元素周期律、晶体中的化学键为解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
13.如表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
(1)表中元素,化学性质最不活泼的是Ar,只有负价而无正价的是F,可用于制半导体材料的元素是Si.
(2)最高价氧化物的水化物碱性最强的是NaOH,电子式为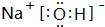 ;酸性最强的是HClO4,呈两性的是Al(OH)3;
;酸性最强的是HClO4,呈两性的是Al(OH)3;
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的HF;
(4)在B、C、D、J、E、F、G、H中,原子半径最大的是Na.
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | |||||
| 3 | B | C | J | F | H | I |
(2)最高价氧化物的水化物碱性最强的是NaOH,电子式为
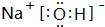 ;酸性最强的是HClO4,呈两性的是Al(OH)3;
;酸性最强的是HClO4,呈两性的是Al(OH)3;(3)A分别与D、E、F、G、H形成的化合物中,最稳定的HF;
(4)在B、C、D、J、E、F、G、H中,原子半径最大的是Na.
18.NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 26g的苯和乙炔的混合物最多可以与2mol的氢气发生加成 | |
| B. | 某温度下,MgCO3的Ksp=4×10-6,则饱和溶液中含Mg2+数目为2×10-3NA | |
| C. | 标准状况下,NA个NO分子和0.5NA个O2分子充分反应后气体体积为22.4 L | |
| D. | 氢气与氯气反应生成标准状况下22.4 L氯化氢,断裂化学键总数为1NA |
8.0.1 mol.L-1KHS溶液中下列表达式不正确的是( )
| A. | c(K+)+c(H+)=c(OH-)+c(HS-)+2 c(S2-) | B. | c(K+)>c(S2-)>c(HS-)>c(OH-)>c(H+) | ||
| C. | c(HS-)+c(S2-)+c(H2S)=0.1 mol•L-1 | D. | c(S2-)+c(OH-)=c(H+)+c(H2S) |
12.中国科学院在世界上首次发现铂元素的一种同位素 ${\;}_{78}^{202}$Pt,它的中子数为( )
| A. | 280 | B. | 202 | C. | 124 | D. | 78 |
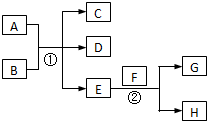 已知常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已略去),请回答下列问题:
已知常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已略去),请回答下列问题: .
.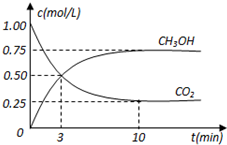 在体积为1L的密闭容器中,充入1mol CO2和3mol H2,在500oC下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ/mol测得CO2和CH3OH(g)的浓度随时间变化如图所示.
在体积为1L的密闭容器中,充入1mol CO2和3mol H2,在500oC下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ/mol测得CO2和CH3OH(g)的浓度随时间变化如图所示.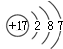 .
.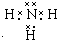 .
.