题目内容
13.迄今为止,由化学能转变的热能或电能仍然是人类使用的主要的能源.I.请仔细观察下列两种电池的构造示意图,完成下列问题:
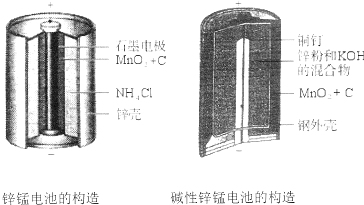
(1)碱性锌锰电池比普通锌锰电池(干电池)性能好,放电电流大.试从影响反应速率的因素分析其原因是碱性锌锰电池用锌粉替代了原锌锰电池的锌壳,增大了反应物的接触面积,加快了反应速率,故放电电流大.
(2)碱性锌锰电池的总反应式:
Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,则负极的电极反应式为Zn+2OHˉ-2eˉ=Zn(OH)2.
Ⅱ.下面是一个将化学能与电能相互转化的装置.回答下列问题:
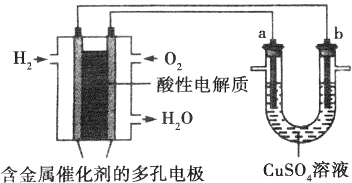
(3)写出通入O2一极的电极反应方程式为O2+4e-+4H+=2H2O.
(4)a电极是阳极,能否写出其电极反应方程式不能(填“能”或“不能”),若“能”写出其电极反应方程式,若“不能”说明其理由因为a电极的电极材料不确定,所以不能写出其电极反应方程式.
(5)下列说法不正确的是BC
A.此装置用于电镀铜时,电解一段时间,硫酸铜溶液的浓度不变
B.U型管中,OH-在a极放电
C.若a为纯净金属,b为粗制金属,该装置可用于粗制金属的精炼
D.电子经导线流入b电极.
分析 I.(1)二者的不同之处在于固体的表面积不同,反应速率不同;
(2)负极发生氧化反应,由方程式可知Zn被氧化生成Zn(OH)2;
Ⅱ.(1)燃料电池中,正极上通入氧化剂,氧化剂得电子发生还原反应;
(2)U型管有外接电源,属于电解池,a为阳极,b为阴极,根据阳极材料书写电极反应式;
(3)A.电镀时,阴极上析出金属与阳极上溶解金属质量相等,则电解质浓度不变;
B.根据阳极电极材料确定放电的物质;
C.电解精炼时,粗金属作阳极;
D.电子从负极流向阴极.
解答 解:I.(1)二者的不同之处在于固体的表面积不同,碱性锌锰电池用锌粉替代了原锌锰电池的锌壳,增大了反应物的接触面积,加快了反应速率,故放电电流大,
故答案为:碱性锌锰电池用锌粉替代了原锌锰电池的锌壳,增大了反应物的接触面积,加快了反应速率,故放电电流大;
(2)负极发生氧化反应,由方程式可知Zn被氧化生成Zn(OH)2,则电极方程式为Zn+2OHˉ-2eˉ=Zn(OH)2,故答案为:Zn+2OHˉ-2eˉ=Zn(OH)2.Ⅱ.(1)左边装置是燃料电池,燃料电池中,通入氧化剂的电极为正极,正极上氧气得电子和氢离子反应生成水,电极反应式为O2+4e-+4H+=2H2O,故答案为:O2+4e-+4H+=2H2O;
(2)U型管有外接电源,属于电解池,a连接原电池正极,所以为阳极,阳极材料未知导致无法判断失电子的物质,所以不能书写电极反应式,故答案为:阳;不能;因为a电极的电极材料不确定,所以不能写出其电极反应方程式;
(3)A.此装置用于电镀铜时,阳极上铜失电子生成铜离子进入溶液,阴极上铜离子放电生成铜,溶解铜的质量等于析出铜的质量,所以电解一段时间,硫酸铜溶液的浓度不变,故正确;
B.U型管中,a是阳极,但阳极材料未知,无法判断阳极上失电子的物质,故错误;
C.电镀时,粗金属作阳极,纯金属作阴极,若b为纯净金属,a为粗制金属,该装置可用于粗制金属的精炼,故错误;
D.电子经导线流入阴极b电极,故正确;
故选BC.
点评 本题考查了原电池和电解池原理,明确各个电极上发生的反应是解本题关键,注意电解池中,阳极上放电的物质与电极材料有关,如果阳极是活泼金属,则金属材料失电子而不是电解质溶液中阴离子失电子,为易错点.

| A. | 再滴加AgNO3溶液,观察是否有AgI沉淀产生 | |
| B. | 加入CC14振荡后,观察下层液体颜色 | |
| C. | 加入CC14振荡后,取上层清液,滴加AgNO3溶液,观察是否有AgCl沉淀产生 | |
| D. | 加入CC14振荡后,取上层清液,滴加KSCN溶液,观察是否有血红色 |
| A. |  称取氢氧化钠 | B. |  浓硫酸稀释 | C. |  过滤溶液 | D. | 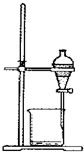 分液操作 |
| A. | C3H8 | B. | C4H10 | C. | C5H12 | D. | C2H4Cl2 |
| A. | 标准状况下,22.4 L苯所含分子数为NA | |
| B. | 1mol甲基所含电子数为10NA | |
| C. | 常温常压下,5.6 g乙烯与丁烯的混合物中含有的氢原子数目为0.8NA | |
| D. | 12 g金刚石中含有C-C键的个数为4NA |
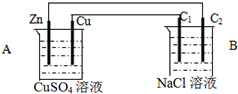 按如图装置进行实验,C1与C2均为石墨棒,回答下列问题
按如图装置进行实验,C1与C2均为石墨棒,回答下列问题  .
.